Химическая кинетика и катализ
Учение о химических процессах состоит из двух частей:
1) химической термодинамики; 2) химической кинетики.
Как уже было показано ранее, химическая термодинамика изучает превращения различных видов энергии при осуществлении химических реакций. Она позволяет количественно определить тепловой эффект химической реакции, возможность самопроизвольного её протекания в том или ином направлении и условия, при которых участвующие в реакции вещества будут находиться в состоянии равновесия. Причём изучение происходящих процессов с позиции термодинамики не требует знаний о их механизме, строении молекул исходных веществ и продуктов реакции.
Ограниченность химической термодинамики заключается в том, что полученных с её помощью результатов часто бывает недостаточно, чтобы осуществить принципиально возможный процесс на практике.
Например, с точки зрения термодинамики, все органические вещества должны были бы уже при обычных условиях достаточно быстро окисляться молекулярным кислородом воздуха до углекислого газа и воды, т.к. этот процесс сопровождается значительным уменьшением энергии Гиббса (Δ G<<0). В связи с этим, существование всего живого на Земле было бы невозможно. Но в действительности данная реакция протекает исключительно медленно.
Ответы на вопросы, почему так происходит, и что нужно сделать, чтобы этот и другие процессы осуществить с необходимой скоростью, даёт химическая кинетика.
Химическая кинетика ( от греческ. kinētikόs – движущий ) – раздел физической химии, изучающий скорость протекания химической реакции во времени, факторы, влияющие на её величину, условия проведения реакции и её возможный механизм с учётом строения молекул участвующих в ней веществ.
Практическое значение её огромно. Так, зная законы кинетики и механизм реакции, можно управлять химическим процессом, сообщая ему необходимую скорость и направление. От этого, в свою очередь, зависит выход конечных продуктов и их себестоимость, производительность аппаратуры в химической промышленности.
От скорости реакции зависит очередность протекания тех или иных биохимических процессов в живых организмах, эффективность действия на них различных лекарственных препаратов, сроки и условия хранения последних до начала их применения.
Следует подчеркнуть, что управление химическим процессом с целью его интенсификации или, наоборот, ингибирования (замедления) является главной задачей химической кинетики
Химическая кинетика состоит из двух разделов: 1) формальной кинетики, дающей математическое описание скорости химической реакции в зависимости от внешних условий (температуры, давления, концентрации исходных веществ), но без учёта механизма самой реакции; 2) молекулярной кинетики, изучающей механизмы протекающих реакций.
Понятие о скорости химической реакции.
Закон действующих масс
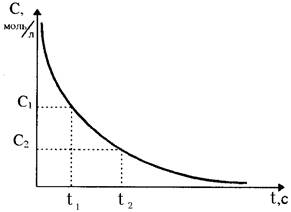
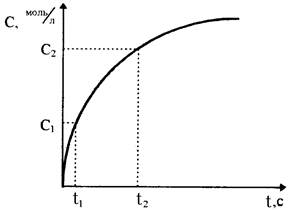
В ходе протекания необратимых химических реакций исходные вещества расходуются, их содержание (или концентрация) в системе уменьшается от начальной величины до нуля. Конечные продукты, наоборот, накапливаются, и с течением времени их концентрация возрастает от нуля до своей максимальной величины (рис.36). Чем за меньший промежуток времени осуществляется этот процесс, тем с большей скоростью протекает химическая реакция.
1 2
 2014-02-09
2014-02-09 813
813








