Соли
Гидроксиды
Химические свойства
Оксиды
Оксиды - это сложные неорганические соединения, молекулы которых состоят из двух видов атомов, одним из которых является кислород со степенью окисление -2.
В зависимости от химических свойств различают:
Солеобразующие оксиды:
основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO.
1. Основный оксид + кислота → соль + вода
CuO + H2SO4 → CuSO4 + H2O
2. Сильноосновный оксид + вода → щелочь
CaO + H2O → Ca(OH)2
3. Сильноосновный оксид + кислотный оксид → соль
CaO + Mn2O7 → Ca(MnO4)2
Na2O + CO2 → Na2CO3
4. Основный оксид + водород → металл + вода
CuO + H2 → Cu + H2O
5. Кислотный оксид + вода → кислота
SO3 + H2O → H2SO4
6. Кислотный оксид + основный оксид → соль
CO2 + CaO → CaCO3
7. Кислотный оксид + основание → соль + вода
SO2 + 2NaOH → Na2SO3 + H2O
8. Нелетучий оксид + соль1 → соль2 + летучий оксид
SiO2 + Na2CO3 → Na2SiO3 + CO2↑
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
ZnO + 2HCl → ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
ZnO + 2KOH + H2O → K2[Zn(OH)4] (в водном растворе)
ZnO + CaO → CaZnO2 (при сплавлении)
В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают:
основные гидроксиды (основания) — гидроксиды, проявляющие основные свойства (например, гидроксид кальция Ca(ОН)2, гидроксид калия KOH, гидроксид натрия NaOH и др.);
кислотные гидроксиды (кислородосодержащие кислоты) — гидроксиды, проявляющие кислотные свойства (например, азотная кислота HNO3, серная кислота H2SO4, сернистая кислота H2SO3 и др.)
амфотерные гидроксиды, проявляющие в зависимости от условий либо основные, либо кислотные свойства (например, гидроксид алюминия Al(ОН)3, гидроксид цинка Zn(ОН)2).
· Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример: 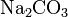 ,
, 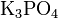 .
.
· Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример: 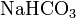 ,
, 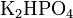 .
.
· Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Пример: 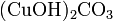 .
.
· Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример: 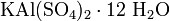 .
.
· Смешанные соли — в их составе присутствует два различных аниона. Пример: 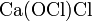 .
.
· Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: 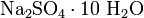 .
.
· Комплексные соли — в их состав входит комплексный катион или комплексный анион. Пример: 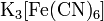 ,
, 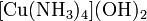
Химические свойства определяются свойствами катионов и анионов, входящих в их состав.
- Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода):
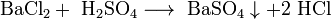
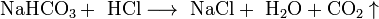
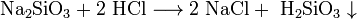
- Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
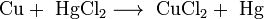
- Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
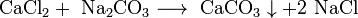
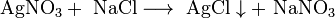
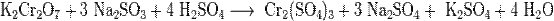
- Некоторые соли разлагаются при нагревании:
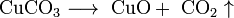
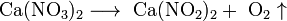
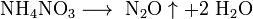
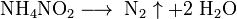
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток.
- Взаимодействие с основными оксидами с образованием соли и воды:
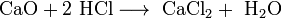
- Взаимодействие с амфотерными оксидами с образованием соли и воды:
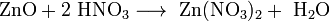
- Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
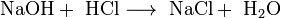
- Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
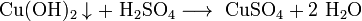
- Взаимодействие с солями, если выпадает осадок или выделяется газ:
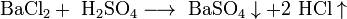
- Сильные кислоты вытесняют более слабые из их солей:
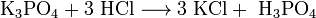
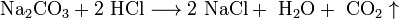
(в данном случае образуется непрочная угольная кислота 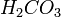 , которая сразу же распадается на воду и углекислый газ)
, которая сразу же распадается на воду и углекислый газ)
- Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты
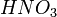 любой концентрации и концентрированной серной кислоты
любой концентрации и концентрированной серной кислоты 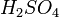 ), если образующаяся соль растворима:
), если образующаяся соль растворима:
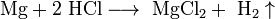
- С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
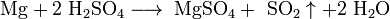
 2014-02-24
2014-02-24 1482
1482
