Щелочи неметаллы
Ионная, ковалентная связь Ковалентная неполярная
Электролиты неэлектролиты
Проводят электрический ток не проводят
ВЕЩЕСТВА (растворы)
Теория электролитической диссоциации
(1887 г. Сванте Аррениус)
оксиды классы орг. вещества
Диссоциация – распад электролита на ионы
В соединениях с ионной связью происходят процессы:
• ориентация молекул воды вокруг вещества
• гидратация - разложение вещества водой
• диссоциация
В соединениях с ковалентной полярной связью происходят процессы:
• ориентация
• гидратация
• ионизация - превращение ковалентной связи в ионную
• диссоциация
Движение ионов
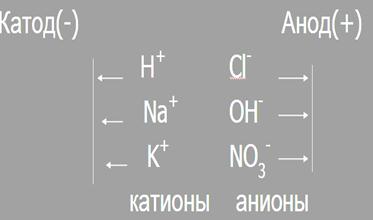
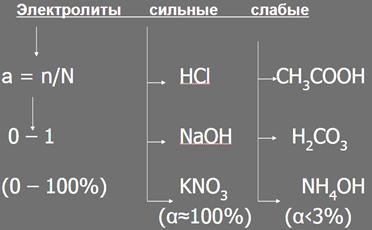
а - степень диссоциации
n - число молекул распавшихся на ионы
N - общее число молекул электролита
Реакции между электролитами называются реакциями ионного обмена:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O - молекулярное уравнение
2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O - полное ионное уравнение
CO32- + 2H+ → CO2↑ + H2O - сокращенное ионное уравнение
 2014-02-24
2014-02-24 459
459








