Технологические свойства аммиака.
Аммиак (NH3) – бесцветный газ с резким запахом и температурой кипения - 33,4˚С и температурой плавления - 77,8˚С Аммиак хорошо растворим в воде (750 литров в литре воды), ограниченно растворим в органических растворителях.
При взаимодействии с водой аммиак образует гидраты следующего состава:
NH3·H2O и NH3·2H2O
Незначительное количество растворенных в воде молекул аммиака ионизирует в результате реакции:
NH3 + H2O «NH4+ + OH–
Степень диссоциации 0.004.
Жидкий аммиак растворяет щелочные и щелочноземельные металлы, фосфор, серу, иод и многие другие неорганические и органические соединения.
При температуре 1300 °С аммиак диссоциирует на азот и водород:
2NH3 = N2 + 3H2
Сухой аммиак образует с воздухом взрывчатые смеси, пределы взрываемости которых зависят от температуры.
Мировое производство аммиака составило в 1980 году более 90 млн. тонн.
Первый завод по производству аммиака был пущен в 1913 году с производительностью 25 т в сутки.
Сырьем в производстве аммиака является азотоводородная смесь (АВС) состава N2:H2 = 1:3. Ресурсы атмосферного азота практически неисчерпаемы, поэтому производство аммиака определяется в основном способом производства водорода.
|
|
|
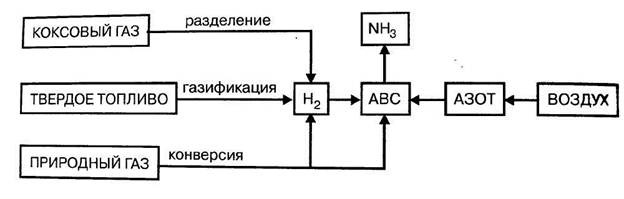
Рисунок 4.3. – Сырьевые ресурсы производства аммиака.
Азот получают ректификацией (перегонкой) сжиженного атмосферного воздуха.
Водород для синтеза аммиака может быть получен:
1. разделением обратного коксового газа,
2. газификацией твердого топлива,
3. конверсией природного газа (метана или его газообразных гомологов),
4. конверсией оксида углерода с водяным паром,
5. крекингом метана
6. электролизом либо термическим разложением воды
Основное значение имеют методы конверсии метана и оксида углерода, а также разделение коксового газа.
Для перспективных планов широкого применения водорода в промышленных и энергетических целях планируется его крупномасштабное производство из воды – самого дешевого сырья, запасы которого неограниченны. Существующие и разрабатываемые методы производства водорода из воды делятся на три группы:
1. электролиз воды
2. термохимические методы
3. комбинированные термо-и электрохимические методы.
ЭЛЕКТРОЛИЗ – наиболее освоенный метод производства водорода из воды, в настоящее время он используется в небольших масштабах при наличии дешевой электроэнергии. Электрохимические процессы основаны на взаимных превращениях электрической энергии в химическую и наоборот. Достоинства электрохимических процессов – их простота в аппаратурном оформлении, малостадийность технологического процесса, высокая чистота получаемых продуктов, надостижимая для химических способов и др. Основной недостаток электролиза – высокий расход электроэнергии, стоимость которой составляет основную долю в себестоимости продуктов – более 90 %. Более того, при промышленном электролизе водных растворов коэффициент использования энергии – не более 50 – 60%, что еще более повышает стоимость продуктов электролиза. При получении водорода электролизом воды применяют в качестве электролита водные растворы кислот, щелочей или солей, так как электропроводность чистой воды ничтожно мала – при 18 °С удельная электропроводность воды составляет (2-6)×10-10 См×м-1. Чаще всего применяют щелочные электролиты, наименее агрессивные для конструкционных материалов электролизеров. Выделение водорода происходит на катоде по реакции:
|
|
|
2H2O + 2 e- ® H2 + 2OH-
Суммарный КПД производства водорода электролизом воды с использованием электроэнергии, вырабатываемой атомной станцией, составляет не более 20 – 30 %, и это отрицательно сказывается на себестоимости водорода. Снижение себестоимости электролитического водорода может быть достигнуто совершенствованием конструкции электролизеров, их удешевлением, и, что амое главное, применением дешевой электроэнергии. Как основная перспектива, рассматривается возможность питания водородных электролизеров «провальной» энергией атомных станций, т.е. использованием электроэнергии в те периоды, когда станции недогружены, например, в ночные часы.
Термохимический метод получения водорода основан на разложении воды с помощью тепловой энергии, которую предполагается получать от атомных реакторов с гелиевым охлаждением, используя теплоту газового теплоносителя на выходе из реактора. Непосредственное разложение воды по реакции
Н2О «Н2 + 0.5 О2 + D H
неосуществимо, так как при необходимой для этого высокой температуре (около 1000 °С) константа равновесия реакции ничтожно мала (10-6). Реализация процесса возможна заменой реакции прямого разложения воды термохимическим циклом, состоящим из нескольких стадий, для каждого из которых значения константы равновесия были бы приемлемы для практики. Разработано и предложено множество термохимических циклов для разложения воды при температурах, доступных с точки зрения использования теплоты охлаждающих газов ядерных реакторов. В большинстве из предложенных циклов промежуточные вещества имеют высокое сродство к водороду, либо к кислороду – это галогены, элементы IV группы (сера), металлы II группы (Mg, Ca. Ba) и переходные элементы с переменной степенью окисления (V, Fe). Ниже приведен один из примеров термохимического цикла реакций, ведущих к разложению воды на H2 и O2:
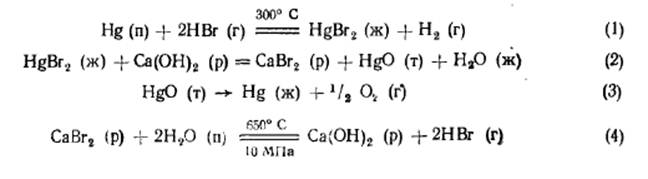
Весь термохимический цикл разложения воды представляет собой замкнутый цикл, так как все исходные реагенты отделяются от продуктов реакции и возвращаются в цикл, за исключением воды, расходуемой на образование водорода и кислорода. Максимальная температура реакций не превышает 700 °С и может быть обеспечена теплоносителем на выходе их атомного реактора на уровне 800 - 900 °С.
В настоящее время ни один из предложенных термохимических циклов еще не реализован в промышленности и значение КПД циклов, а так же расчеты затрат на получение водорода этим методом пока не определены.
Комбинированный метод производства водорода заключается в комбинировании термо- и электрохимических стадий процесса. Ожидаемые преимущества комбинированного метода состоят в том, что могут быть использованы достоинства каждого из рассмотренных способов: электрохимический хорошо освоен, имеет простое аппаратурное оформление, а термохимический более экономичен, но мало освоен и включает стадии, трудные для промышленного осуществления.
Примером может служить сернокислотный комбинированный цикл получения водорода и кислорода из воды. Это двухступенчатый процесс, включающий 2 стадии
|
|
|
1. термохимическая – эндотермическая реакция, осуществляемая при 900 °С
Н2SO4 = H2O + SO2 + ½ O2
2. низкотемпературный электрохимический процесс:
2H2O + SO2 - 2e- = H2 + H2SO4
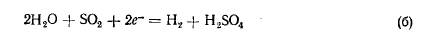
Последняя реакция может быть реализована только путем электролиза, так как ее константа равновесия и теоретическим выход водорода чрезвычайно малы. Источником энергии для комбинированной установки может служить атомный газовый реактор, снабжающий отбросной теплотой термохимическую стадию и электроэнергией электрохимическую стадию. Расчетные затраты для комбинированной установки меньше, чем для прямого электролиза воды. Суммарный КПД процесса должен составить 35 – 37 %. По мнению специалистов комбинирование термохимических и электрохимических стадий – наиболее перспективное направление крупномасштабного производства водорода из воды.
Основным методом получения водород а для синтеза аммиака является каталитическая конверсия метана. Сырьём для этого метода служит природный и попутный газ, содержащий до 90-98% метана.
 2014-02-24
2014-02-24 14445
14445
