Производство аммиака
Лекция 4
СОВЕРШЕНСТВОВАНИЕ СЕРНОКИСЛОТНОГО ПРОИЗВОДСТВА
Большие масштабы производства серной кислоты особенно остро ставят проблему его совершенствования. Здесь можно выделить следующие основные направления:
1. Расширение сырьевой базы за счет использования отходящих газов котельных теплоэлектроцентралей и различных производств
2. Повышение единичной мощности установок. Увеличение мощности в 2-3 раза снижает себестоимость продукции на 25-30 %
3. Интенсификация процесса обжига сырья путем использования кислорода или воздуха, обогащенного кислородом. Это уменьшает объем газа, проходящего через аппаратуру и повышает ее производительность.
4. Повышение давления в процессе, что способствует увеличению интенсивности работы основной аппаратуры.
5. Применение новых катализаторов с повышенной активностью и низкой температурой зажигания
6. Повышение концентрации SO3 в печном газе, подаваемом на контактирование.
7. Внедрение реакторов кипящего слоя на стадиях обжига сырья и контактирования
8. Использование тепловых эффектов химических реакций на всех стадиях производства, в том числе для выработки технологического пара.
9. Создание энерготехнологических схем, в которых комбинируются технологические (получение серной кислоты) и энергетические (выработка электроэнергии) процессы переработки одного и того же сырья.
Производство аммиака .
Соединения азота и их значение для народного хозяйства. Промышленные методы связывания азота, их сравнительная характеристика.
Сырье в производстве аммиака. Методы получения водорода и азотоводородной смеси (АВС) для синтеза аммиака. Двухстадийный процесс получения АВС из метана конверсией с водяным паром и воздухом, с последующей конверсией оксида углерода (II). Очистка конвертированного газа. Синтез аммиака из АВС, как пример каталитического процесса, осуществляемого по циклической (круговой) схеме. Теоретические основы синтеза. Состав катализатора и каталитические яды. Предкатализ и его назначение. Промышленные способы синтеза аммиака. Принципиальная схема производства аммиака при среднем давлении. Устройство колонны синтеза - каталитического реактора, работающего при высоких температурах идавлениях. Использование теплоты реакции для поддержания автотермичности процесса.
Соединения азота имеют исключительное значение для различных отраслей промышленности и сельского хозяйства.
Соединения азота используются при производстве азотной кислоты, разнообразных минеральных удобрений, полимерных материалов, взрывчатых веществ, ракетных топлив, красителей, лекарственных препаратов.
Азот принадлежит к числу достаточно распространенных химических элементов, но его содержание в различных сферах Земли колеблется в различных пределах:
планета в целом – 0.01 масс. %
земная кора – 0.04 масс. %
атмосфера – 75.5 масс. %
Формы существования азота в земной коре весьма разнообразны. Он входит в состав различных минералов, содержится в каменном угле, нефти и других видах ископаемого топлива.
АЗОТ ИМЕЕТ ВАЖНЕЙШЕЕ ЗНАЧЕНИЕ ДЛЯ ЖИЗНИ НА ЗЕМЛЕ, являясь одним из элементов, входящих в состав белковых структур, без которых невозможно существование живой клетки. На рисунке 4.1 представлены формы существования азота на земле и содержание элемента в них.
Основным природным источником азота является атмосфера. Масса азота в ней составляет 8·104 т / га суши. Однако газообразный молекулярный азот представляет одно из самых устойчивых химических соединений. Энергия связи в молекуле азота равна 940,5 кДж/моль.
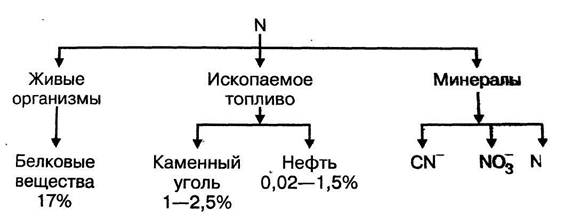
Рис. 4.1 – формы существования азота в литосфере.
ЭЛЕМЕНТАРНЫЙ АЗОТ ПРАКТИЧЕСКИ НЕ РЕАКЦИОННОСПОСОБЕН. В естественных условиях лишь незначительное количество атмосферного азота переходит в биологически усвояемую форму в результате грозовых разрядов по реакции
N2 + O2 ® 2NO
Либо непосредственно фиксируется ограниченными видами растений в форме аминокислот в ходе фотосинтеза, катализируемого ферментами
N (атм) ® N (бакт) ® N (связанный)
Большинство организмов (высшие растения и животные) усваивают азот в виде соединений со степенью окисления -3 и не могут использовать азот атмосферы. Скорость же перевода атмосферного азота в состояние, в котором он может быть усвоен, в природных процессах крайне мала. В то же время организация современного культурного земледелия связана с непрерывным выводом азота из почвы, поэтому необходимо постоянно пополнять содержание азота в почве, причем в форме, усваиваемой растениями. Это достигается внесением минеральных солей – удобрений.
До конца XIX века источником связанного азота, т.е. соединений азота, служили природные соли аммиачная или чилийская селитра - нитраты калия и натрия. Однако запасы этих солей крайне ограничены и неравномерно распределены. Поэтому возникла необходимость разработки технологии связывания атмосферного азота.
 2014-02-24
2014-02-24 2602
2602
