Реакция синтеза аммиака из АВС представляет собой обратимую, экзотермическую реакцию, протекающую с уменьшением объёма.
N2 + 3H2 = 2NH3 + Q
Равновесие этой реакции в соответствии с принципом Ле-Шателье может быть смещено вправо:
1. При снижении температуры
2. При повышении давления
Для получения примерно 97 % превращения азота и водорода в аммиак при 400 °С необходимо применять давление выше 350 МПа.
Зависимость равновесного выхода аммиака от температуры и давления приведена на рисунке 4.6.
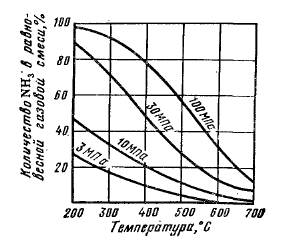
| Рис. 4.6. Зависимость равновесного выхода аммиака от температуры для различных давлений. |
При 450 °С и 10 МПа в равновесной газовой смеси содержит всего 16 % NH3, а при давлении 30 МПа равновесный выход уже составляет 36 %. Но влияние давления на фактический выход аммиака характеризуется затухающей кривой, поэтому применять очень высокие давления экономически невыгодно.
Выход аммиака повышается с понижением температуры. Однако при этом падает скорость процесса катализа, а следовательно, и общая производительность цеха Даже при сравнительно высоких температурах активационный энергетический барьер молекул азота слишком велик, и образование аммиака протекает крайне медленно. Для снижения энергии активации процесс синтеза ведут на твердых катализаторах при 400 – 500 °С.
Реакция протекает с большой скоростью лишь в присутствии катализатора, значительная активность которого проявляется только при температуре не ниже 450-500ºС.
Однако получить значительный выход аммиака можно только при применении высоких давлений.
На основании этого промышленный синтез аммиака осуществляется при температуре 450-500ºС, с использованием катализаторов и высоких давлений.
Остановимся на каждом из этих параметров боле подробно:
1) Температура. Мы уже с вами говорили о том, что для процесса синтеза аммиака существенное значение имеет оптимальный температурный режим.
Синтез аммиака является экзотермической реакцией. Здесь, как и в случае окисления оксида серы в присутствии катализатора, имеет место противоречие, возникающее при проведении обратимых экзотермических реакций.
Противоречие состоит в том, что:
- повышение температуры при экзотермической реакции приводит к уменьшению выхода продукта;
- в то время как снижение температуры влечёт за собой уменьшение скорости реакции.
Решение проблемы заключается в том, что для обеспечения максимальной скорости синтеза процесс следует начинать при максимальной температуре и по мере увеличения степени превращения снижать её в соответствии с режимом оптимальных температур.
2) Каталитической активностью по отношению к реакции синтеза аммиака обладают металлы, имеющие незавершённый второй снаружи d- или f- электронный уровень: железо, уран, платина и молибден. Наиболее высокую активность проявляют железо, осьмий, рений и уран. Однако рений, осмий и уран дороги и опасны в работе.
В промышленности в качестве катализатора синтеза аммиака используется железо, содержащее активаторы (промоторы), введённые в катализатор в процессе его изготовления.
В качестве промоторов используют оксидыщелочных и щелочноземельных металлов: {Al2O3 + K2O + CaO +SiO2} Такой катализатор достаточно активен и стоек к местным перегревам.
СОЕДИНЕНИЯ СЕРЫ ОТРАВЛЯЮТ КАТАЛИЗАТОР НЕОБРАТИМО, КИСЛОРОД и СО – НЕОБРАТИМО, НО ОЧЕНЬ БЫСТРО И ДАЖЕ В НИЧТОЖНО МАЛЫХ КОНЦЕНТРАЦИЯХ.
Контактную массу готовят сплавлением смеси оксидов железа (Fe3O4), алюминия, калия, кальция и кремния с последующим измельчением массы до размера зёрен катализатора (5 мм).
Оксид железа восстанавливается до свободного железа водородом в колонне синтеза аммиака.
Гетерогенный каталитический процесс синтеза аммиака на железном катализаторе проходит в три стадии.
1. Диффузия азота и водорода из газового объема к поверхности зерна катализатора и в его порах;
2. Активированная адсорбция азота и водорода поверхностью катализатора;
3. Химическое взаимодействие азота и водорода через промежуточные соединения их с катализатором.
В соответствии с представлениями электронной теории катализа водород передает свои электроны катализатору, а азот воспринимает их от катализатора, восстанавливая электронное равновесие. Перегруппировка поверхностных соединений N×Кат и H×Кат проходит последовательно через низшие соединения азота с водородом: имид NH, амид NH2, и, наконец, аммиак NH3
4. Десорбция аммиака и диффузия его в газовый объем.
Установлено, что лимитирующей стадией собственно катализа является активированная адсорбция азота.
На первой стадиипроисходитактивированная адсорбция атомами железа молекул водорода (диссоциирующих на атомы) и азота (умолекул азота разрывается одна из связей ) на поверхности катализатора.
На второй стадии идёт последовательное гидрирование молекулы азота по схеме (Рис. 4.7):
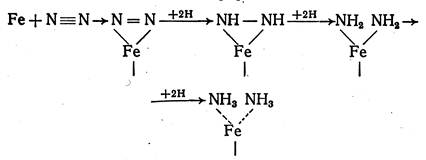
Рис. 4.7. Схема реакции синтеза аммиака на поверхности катализатора
3) Давление. Определяющим параметром в производстве аммиака из АВС является давление синтеза.
В зависимости от применяемого давления все системы производства аммиака делятся на:
- системы низкого давления (10 – 15 МПа);
- системы среднего давления (25 –60 МПа) – наиболее часто применяется;
- системы высокого давления (60–100 МПа).
Однако даже при использовании систем высокого давления не удаётся добиться полного превращения АВС в аммиак.
В связи с этим при производстве аммиака из АВС применяют принцип циркуляции.
Принцип циркуляции заключается в следующем:
1) Аммиак, образовавшийся после прохождения АВС через контактные массы, конденсируется при охлаждении газовой смеси и отделяется от неё.
2) Непрореагировавшая АВС с остатком аммиака (циркуляционный газ) смешивается со свежей порцией АВС и снова подаётся на катализатор и т. д.
3) Циркуляция продолжается до полного превращения исходных веществ.
 2014-02-24
2014-02-24 9318
9318
