Задачи
В С
Ответы
6.3. 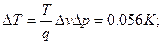
6.6. 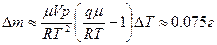 , где
, где  - объем пара;
- объем пара;
6.7. 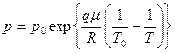 , где р0 – давление насыщенного пара при Т0;
, где р0 – давление насыщенного пара при Т0;
6.8. 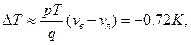
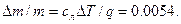
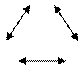
Термодинамическое равновесие обладает свойством транзитивности: если системы А и В находятся в термодинамическом равновесии и системы В и С находятся в термодинамическом равновесии, то системы А и С также находятся в термодинамическом равновесии между собой.
 А
А
Нулевой, или общий принцип обеспечивает полноту системы постулатов макроскопической теории и является надежным обоснованием процедуры измерения температуры с помощью термометра.
0.1. Два теплоизолированных сосуда с объемами V1 и V2 соединены трубкой с краном. До открытия крана в первом сосуде содержался азот под давлением p1 и при температуре T1, а во втором аргон под давлением p2, при температуре T2. Определить, какая температура Т и какое давление р установится в смеси газов, если открыть кран.
0.2. Даны две изолированные системы: одна – термометр с термометрическим телом, масса которого m1 , вторая – исследуемое тело массой m2, температуры соответственно T1, T2.
1) Определить разность Δt между температурой полученной в результате измерения и исходной температурой исследуемого тела в случаях:
а) С1 = С2
б) С1 ≠ С2, (теплоемкости удельные).
2) Какой должна быть масса ртути в термометре, чтобы Δt= 0,0001ºС, если измеряем температуру здорового человека массой 70 кг, при комнатной температуре 20ºС.
3) С помощью какого термометра измерение температуры воды будет более точным: спиртового или ртутного? Масса
Допустим, что число фаз вещества, находящихся в равновесии друг с другом равно трем, если это изобразить на плоскости p, T, то она получится разделена на три области: твердую фазу (т), жидкую (ж) и газообразную (г) (рис.20).
Границами соприкасающихся фаз являются кривые сублимации (испарение твердого тела), испарения и плавления, характеризующие двухфазные равновесные состояния.

|

|

|
Подобные диаграммы строят экспериментально для разных веществ, они позволяют предсказывать в каких равновесных состояниях может находиться вещество при тех или иных значениях давления и температуры, а также когда и какие оно будет испытывать фазовые превращения при том или ином процессе. Например, кривая испарения заканчивается в критической точке К, поэтому возможен непрерывный переход вещества из жидкого состояния в газообразное и обратно путем обхода точки К «сверху», в этом случае такой переход не сопровождается двухфазным состоянием.
 2014-02-24
2014-02-24 348
348








