Задачи
Ответы
Список литературы
Нулевое (общее) начало термодинамики
Рис. 1. Рис.2. Рис. 3.
Задачи занятия: 1. Закрепить технику передачи мяча двумя руками снизу
2. Закрепить выполнение блокирующих действий;
3. Совершенствовать перемещения по средствам подвижной игры.
Место проведения: спортивный зал баскетбола и волейбола БГУФК.
Используемый инвентарь: волейбольные мячи.
Используемая литература: Беляев, А. В. Волейбол на уроке физической культуры / А. В. Беляев, - 2-е изд. – М.: «Физкультура и спорт», 2005, - 144 с., ил.
Ключевым понятием термодинамики является состояние термодинамического равновесия.
Термодинамическое равновесие – это стационарное состояние изолированной системы, в котором ее макроскопические параметры (давление p, объем V, температура T) сохраняют свои постоянные значения во времени и в занимаемом системой пространстве.
Самопроизвольный процесс перехода системы в состояние термодинамического равновесия называется релаксацией; время, затраченное на этот переход – временем релаксации.
Нулевое начало постулирует сам факт возможности установления термодинамического равновесия между разными телами при определенных условиях.
Если две системы А и В приведены в непосредственный контакт друг с другом и изолированы, то полная система А+В в конечном итоге переходит в состояние термодинамического равновесия; каждая из систем А и В в отдельности также будет находиться в состоянии термодинамического равновесия. Это равновесие не нарушится, если устранить контакт между системами, а затем через некоторое время восстановить его.
1. Иродов И.Е. Задачи по общей физике. – СПб.: Лань, 2001.
2. Иродов И.Е. Физика макросистем. Основные законы. – М.: Лаборатория Базовых Знаний, 2001.
3. Кассандрова О.Н., Матвеев А.Н., Попов В.В. Методика решения задач по молекулярной физике./ Под общей ред. А.Н. Матвеева. - М.: Изд-во МГУ, 1982.
4. Кубо Риого. Термодинамика. Современный курс с задачами и решениями. – М.: Наука, 1970.
5. Матвеев А.Н. Молекулярная физика. - М.: Высш. шк., 1987.
6. Общая физика. Молекулярная физика. Определение основных характеристик фазовых переходов 1-го рода при кипении воды: Метод. указания к лабораторной работе. –Красноярск, КрасГУ, 2000.
7. Орир Дж. Физика. Т.1. – М.: Мир, 1981.
8. Сборник задач по общему курсу физики. Термодинамика и молекулярная физика. /Под ред. Д.В. Сивухина. – М.: Наука, 1976.
9. Сивухин Д.В. Общий курс физики. Т.2. – М.: Наука, 1979.
жидкости в термометре 0,2г, масса воды 1кг (Cртути=120 Дж/кгК; Своды=4190 Дж/кгК; Сспирта=2430 Дж/кгК).
0.3. Как известно, моделей вечных двигателей предлагалось великое множество. Можно ли назвать опыт Дарлинга примером возможного вечного движения?
Опыт заключается в следующем: в прозрачном стеклянном сосуде, наполненном водой, движется крупная капля (~1 см³) анилина; нижняя стенка сосуда имеет температуру значительно выше, чем температура верхней стенки. Опускаясь под своей тяжестью вниз, капля нагревается, в результате чего поднимается вверх, где начинает охлаждаться, после этого она опять опускается, и движение повторяется вновь и вновь.
1) Объясните «подъем» капли анилина. (при t=20ºС ρанилина =1,03 г/см³, ρводы = 1,00 г/см³)
2) Можно ли назвать данную систему вечным двигателем? Является ли она изолированной? Происходит ли в данной системе процесс установления теплового равновесия? Где именно?
0.1. 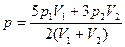 ;
; 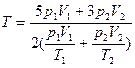
0.2. 1) а. 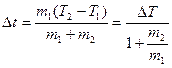 ;
;
б. 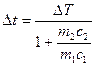 ;
;
2) m1=0,7г;
3) с помощью ртутного.
6.1. Получить уравнение Клапейрона-Клаузиуса методом циклов.
6.2. Вывести уравнение Клапейрона-Клаузиуса методом термодинамического потенциала.
6.3. Ромбическая сера превращается в моноклинную при 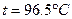 . При атмосферном давлении удельная теплота превращения
. При атмосферном давлении удельная теплота превращения 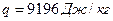 . Скачок удельного объема серы при фазовом превращении
. Скачок удельного объема серы при фазовом превращении 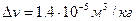 . Найти смещение
. Найти смещение 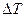 точки фазового перехода серы при изменении давления на
точки фазового перехода серы при изменении давления на 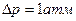 .
.
6.4. Кусочек льда массы 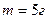 непрерывно нагревают при атмосферном давлении от температуры
непрерывно нагревают при атмосферном давлении от температуры 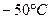 до
до 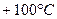 , пока все вещество не перейдет в пар. Построить график зависимости энтропии воды от абсолютной температуры
, пока все вещество не перейдет в пар. Построить график зависимости энтропии воды от абсолютной температуры 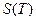 на всем вышеуказанном интервале температур.
на всем вышеуказанном интервале температур.
6.5. При стремлении температуры фазового перехода «жидкость – пар» к критической температуре Тк удельная теплота испарения (конденсации) стремится к нулю. Объяснить это свойство с помощью уравнения Клапейрона-Клаузиуса.
6.6. В закрытом сосуде с объемом 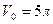 находится 1 кг воды при температуре
находится 1 кг воды при температуре 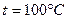 . Пространство над водой занято насыщенным водяным паром (воздух выкачан). Найти увеличение массы насыщенного пара
. Пространство над водой занято насыщенным водяным паром (воздух выкачан). Найти увеличение массы насыщенного пара 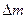 при повышении температуры системы на
при повышении температуры системы на 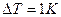 . Удельная теплота парообразования
. Удельная теплота парообразования 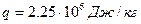 . При расчетах пар считать идеальным газом. Удельным объемом воды пренебречь по сравнению с удельным объемом пара.
. При расчетах пар считать идеальным газом. Удельным объемом воды пренебречь по сравнению с удельным объемом пара.
6.7 Найти зависимость давления насыщенного пара от температуры в следующих упрощающих предположениях: удельную теплоту парообразования q считать не зависящей от температуры; удельный объем жидкости пренебрежимо
системе, чтобы повысить ее температуру на 1 К. Тогда
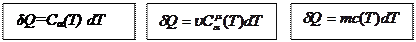 (4)
(4)
где α – параметр, определяющий процесс;
υ – количество молей вещества;
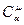 – молярная теплоемкость;
– молярная теплоемкость;
Cμ/μ = с – удельная теплоемкость; m – масса тела.
Молярные теплоемкости Cp,Cv являются функциями состояния;
| Cp- Cv= R – уравнение Майера (справедливо только для идеального газа) |
Уравнение процесса задается функциональной связью двух макроскопических параметров, описывающих систему. На соответствующей координатной плоскости (PV, TV или PT) уравнение процесса наглядно представляется в виде графика (кривой процесса).
Уравнение определенного процесса может быть получено с помощью первого начала термодинамики, а также информации о процессе и системе: U(T,V), p(T,V), Сα(Т).
Важный класс процессов составляют политропические процессы. Политропическим называется процесс, проходящий при постоянной теплоемкости С. Кривая, изображающая политропический процесс, называется политропой.
б) 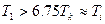 ;
;
5.8. 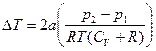 .
.
 2014-02-24
2014-02-24 428
428







