Внутренняя энергия
Нулевое начало. Задачи для самостоятельной работы
Введение в термодинамику. Основные понятия.
ТЕРМОДИНАМИКА
МОЛЕКУЛЯРНАЯ ФИЗИКА
План-конспект семинарских занятий
Часть 2
Красноярск 2006
Термодинамический подход в описании макроскопических систем использует термодинамические величины, относящиеся к системе в целом – макроскопические параметры. В экспериментальных исследованиях устанавливаются связи между различными параметрами.
Уравнение, выражающее функциональную связь между макроскопическими параметрами в состоянии термодинамического равновесия, называется обобщенным уравнением состояния системы. Известными примерами уравнений такого рода являются уравнение Клапейрона-Менделеева и уравнение Ван-дер-Ваальса.
Фундамент термодинамической теории образуют четыре постулата, или принципа. В российской научной традиции их принято также называть началами термодинамики и нумеровать, начиная с нулевого. Номер однозначно кодирует содержание начала, его логическое место и функцию в системе постулатов.
Важнейшими исходными понятиями термодинамики являются внутренняя энергия системы, макроскопическая работа и теплота.
В общем случае внутренняя энергия системы U зависит от ее температуры Т и занимаемого ею объема V.
Для идеальной системы (системы без межмолекулярного взаимодействия) U зависит только от Т. Например, для идеального двухатомного газа в широком диапазоне температур молярная величина U(T)=5/2RT.
Термодинамические величины, обладающие свойствами 1), 2), 3), называются функциями состояния или термодинамическими потенциалами.
Введение в термодинамику. Основные понятия.
Нулевое начало. Задачи для самостоятельной работы ………. 3
Семинар 1. Первое начало термодинамики.
Теплоемкость. Процессы в газах ……….………… 9
Семинар 2. Циклические процессы.
Тепловые процессы и их эффективность …….…..12
Семинар 3. Второе начало термодинамики.
Энтропия ……………………………….…………...18
Семинар 4. Реальные газы ………………………………...…….23
Семинар 5. Внутренняя энергия газа Ван-дер-Ваальса.
Эффект Джоуля-Томсона …………….……………27
Семинар 6. Фазовые переходы первого рода.
Уравнение Клапейрона-Клаузиуса ………………31
Список литературы ……..………………………………………35
ремещении поршня на dx, равна
δA=Fdx=psdx=pdV
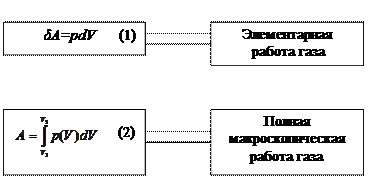
 Положительной считается работа, совершаемая газом при расширении: dV>0, δA>0; отрицательной – совершаемая над газом внешними силами при сжатии: dV<0, δA<0.
Положительной считается работа, совершаемая газом при расширении: dV>0, δA>0; отрицательной – совершаемая над газом внешними силами при сжатии: dV<0, δA<0.
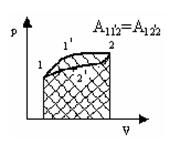
На диаграмме – pV (рис.2) величина макроскопической работы выражается площадью под кривой, изображающей определенный процесс.
|
Работа не является термодинамическим
потенциалом.
Количество тепла (теплота)
Теплота Q – это величина, характеризующая взаимодействие систем в форме теплообмена. Теплообмен осуществляется путем передачи внутренней энергии макросистеме от внешних тел как
мал по сравнению с удельным объемом пара; к жидкости применимо уравнение состояния Клапейрона. (Эти упрощения допустимы вдали от критической температуры, если интервал изменения температур не слишком широк.)
6.8. Кусок льда помещен в адиабатическую оболочку при температуре 0˚С и атмосферном давлении. Как изменится температура льда, если его адиабатически сжать до давления 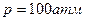 ? Какая доля льда
? Какая доля льда 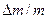 при этом расплавится? Удельные объемы воды
при этом расплавится? Удельные объемы воды 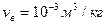 , льда
, льда 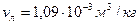 . Теплоемкости воды и льда связаны соотношением
. Теплоемкости воды и льда связаны соотношением 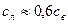 .
.
 2014-02-24
2014-02-24 441
441







