Свойства и фазовые переходы реальных газов
Раздел 2. Реальные газы. Водяной пар
Вопросы для самопроверки
1. Какой цикл называется прямым и какой обратным?
2. С помощью каких величин определяют степень совершенства прямых и обратных циклов?
3. Из каких процессов состоит цикл Карно?
4. Сформулируйте теорему Карно?
5. Какой цикл называется регенеративным?
6. Как влияет необратимость на процесс преобразования теплоты в работу?
7. В чем сущность второго закона термодинамики?
8. Приведите различные формулировки второго закона термодинамики.
9. Приведите аналитическое выражение второго закона термодинамики?
10. В чем сущность статистического истолкования второго закона термодинамики.
11. Как связаны энтропия и термодинамическая вероятность состояния?
12. В чем заключается различие между адиабатным и изоэнтропным процессами? В каких случаях адиабатный процесс является одновременно и изоэнтропным?
13. Что такое эксергия теплоты?
14. Приведите выражение для эксергетического КПД.
15. Как идут линии основных процессов в Ts – диаграмме идеального газа?
16. Приведите формулы для расчета изменения энтропии идеального газа в различных процессах.
17. Как строится абсолютная термодинамическая шкала температур?
Раздел содержит пять тем, одну лабораторную работу (№ 4) и контрольную работу (зад. № 5,6,7,8). А также вопросы для самопроверки и контрольный тест из десяти вопросов (№ 2). Максимально возможное число баллов по этому разделу составит 45 баллов для очно-заочной форм обучения.
Термодинамические свойства реальных веществ. Фазовая pv – диаграмма. Уравнение Ван – Дер – Ваальса. Критические параметры веществ. Принцип соответственных состояний. Термодинамическое подобие. pv – p – диаграмма. Коэффициент сжимаемости. Условия равновесия при фазовом переходе. Правило фаз Гиббса. Парообразования и конденсация. Зависимость давления насыщенного пара от температуры. Теплота фазового перехода. Плавление. Сублимация. Уравнение Клапейрона – Клаузиуса. Фазовая pT – диаграмма. Тройная точка. Аномалии воды.
По теме не предусмотрены лабораторные и контрольные работы. После изучения теоретического материала следует ответить на вопросы для самопроверки по этой теме. Ответы можно найти в учебниках [1,3].
В реальных газах учитываются объемы молекул и силы межмолекулярного взаимодействия между молекулами. При очень малых расстояниях преобладают силы отталкивания, а с увеличением расстояний начинают преобладать силы притяжения. Поэтому молекулы реального газа обладают внутренней потенциальной энергией. Внутренняя потенциальная энергия реальных газов зависит от среднего расстояния между молекулами.
Сжимаемость реальных газов – способность вещества изменять свой объем под действием всестороннего давления. Наличие у молекул реальных газов конечного по величине объема и сил притяжения между молекулами являются отличительными признаками реальных газов от идеальных.
Сжимаемость газов при давлениях до 100 МПа, по мере приближения их плотности к плотности жидкостей, становится близкой к сжимаемости жидкостей. Для описания термодинамических свойств реальных газов, как было отмечено ранее, применяется уравнение Ван – Дер – Ваальса
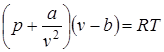 . (2.1)
. (2.1)
Численные значения постоянных a, b, R подсчитываются по критическим параметрам вещества: Тк – критической температуре, рк – критическому давлению, vк – критическому удельному объему, которые определяются экспериментально.
Таблица 2.1
 2014-02-24
2014-02-24 1049
1049
