Параметры состояния реального газа р, Т, v определяются через значения двух других параметров, т.е.
р=f1(v, T); v=f(р,T); T=f3(v, p), которые являются различными формами уравнения состояния. Поскольку эти параметры обладают свойствами функций состояния, можно их представить через полные дифференциалы:
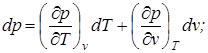
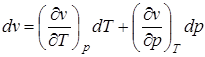 ;
;
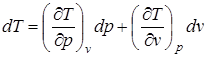 . (2.6)
. (2.6)
Из шести частных производных, приведенных в уравнениях, самостоятельное значение имеют только три, которые называются термическими коэффициентами
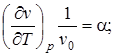
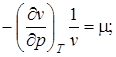
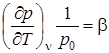 , (2.7)
, (2.7)
где 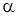 -термический коэффициент расширения (при р- const), характеризует интенсивность увеличения объема при нагревании;
-термический коэффициент расширения (при р- const), характеризует интенсивность увеличения объема при нагревании;
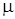 -термический коэффициент сжатия, характеризует интенсивность изменения объема при изменении давления в условиях T – const;
-термический коэффициент сжатия, характеризует интенсивность изменения объема при изменении давления в условиях T – const;
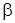 -термический коэффициент давления, характеризует интенсивность изменения давления при (v -const) изохорическом нагревании тела.
-термический коэффициент давления, характеризует интенсивность изменения давления при (v -const) изохорическом нагревании тела.
В указанных выше выражениях р0 и v0 – давление и удельный объем при температуре 0ºС.
Названные коэффициенты связаны между собой соотношением
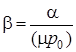 .
.
Последнее выражение позволяет вычислить коэффициент упругости, который экспериментально установить трудно, в то время, как 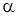 и
и 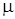 легко определяются опытным путем.
легко определяются опытным путем.
Калорические свойства газов описываются зависимостями через параметры состояния реального газа р, v. T следующего вида:
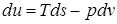 ;
; 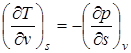 ;
;
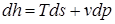 ;
; 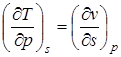 ; (2.8)
; (2.8)
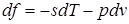 ;
; 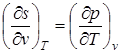 ;
;
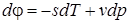 ;
; 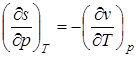 .
.
Эти дифференциальные зависимости называются уравнениями Максвелла.
Связь между теплоемкостями ср и сv для реального газа через термические коэффициенты описывается следующей формулой:
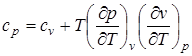 . (2.9)
. (2.9)
Приведенное уравнение позволяет на основе экспериментальных значений ср вычислить сv, которую из опыта определить трудно.
 2014-02-24
2014-02-24 1931
1931
