Фазовое равновесие – одновременное существование термодинамических равновесных фаз в многофазной системе. Например, равновесие жидкости со своим насыщенным паром, равновесие льда и воды при температуре плавления, для металлов и их сплавов наличие твердой и жидкой фазы в процессе их плавления. В условиях равновесия при переходе частиц многофазной среды из одной фазы в другую энергия системы не меняется.
Число термодинамических переменных, которые можно изменить не нарушая условий фазового равновесия называется числом степеней свободы системы F и оно равно F=К+2 - 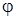 , где
, где 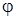 - число фаз, находящихся в равновесии, К – число компонентов в системе. Например, в двухкомпонентной системе три фазы могут находиться в равновесии при разных температурах, но давление и концентрации компонент полностью определяются температурой.
- число фаз, находящихся в равновесии, К – число компонентов в системе. Например, в двухкомпонентной системе три фазы могут находиться в равновесии при разных температурах, но давление и концентрации компонент полностью определяются температурой.
Для двухфазовой равновесной однокомпонентной системы давление является функцией температуры. Эта зависимость выражается уравнением Клапейрона - Клаузиуса:
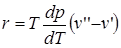 , (2.2)
, (2.2)
где r –теплота фазового перехода, Т – температура фазового перехода; 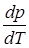 – производная от давления по температуре; (
– производная от давления по температуре; (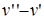 ) – изменение объема вещества при переходе вещества из одной фазы в другую. Уравнение Клапейрона - Клаузиуса применимо к любым фазовым переходам, сопровождающимся поглощением или выделением теплоты (т.е. фазового перехода I рода).
) – изменение объема вещества при переходе вещества из одной фазы в другую. Уравнение Клапейрона - Клаузиуса применимо к любым фазовым переходам, сопровождающимся поглощением или выделением теплоты (т.е. фазового перехода I рода).
Графики, изображающие зависимость одних термодинамических переменных от других в условиях фазового равновесия называются линиями равновесия, а их совокупность – диаграммами состояния. Линия фазового равновесия может пересекаться с другой линией равновесия (тройная точка), либо закончиться критической точкой, координаты которой на термодинамической поверхности представлены значениями Тк, рк, vк. Она определяет точку фазового перехода.
Фазовый переход – переход вещества из одной фазы в другую при изменении внешних условий (температуры, давления и т.д.) или скачкообразное изменение физических свойств при непрерывном изменении внешних параметров.
Различают фазовый переход I рода, при котором скачком изменяются термодинамические характеристики вещества, такие как плотность, концентрация компонентов, при этом в единице массы выделяется или поглощается определенное количество теплоты, которая называется теплотой перехода и равна произведению температуры фазового перехода на разность энтропии в двух фазах между которыми происходит переход. Различают удельную массовую и мольную теплоту фазового перехода.
Фазовый переход II рода – это переход, при котором отсутствует скачкообразное изменение внутренней энергии и плотности. Теплота фазового перехода II рода равна нулю.
Сублимация – переход вещества из кристаллического состояния непосредственно (без плавления) в газообразное с поглощением теплоты.
К фазе перехода I рода относятся: испарение, конденсация, плавление, затвердевание, сублимация и конденсация в твердую фазу и другие структурные переходы.
Для реальных газов, например, влажного пара, имеет место, когда в равновесной системе одно и то же вещество находится в двух различных агрегатных состояниях. При этом мелкодисперсные частицы жидкости взвешены в сухом насыщенном паре, причем жидкость отделена от пара поверхностью этих частиц. Таким образом, отдельные части равновесной системы, находящиеся в различных агрегатных состояниях и отделенные друг от друга поверхностью раздела, называются фазами такой системы, а происходящий переход из одного агрегатного состояния в другое называется фазовым превращением.
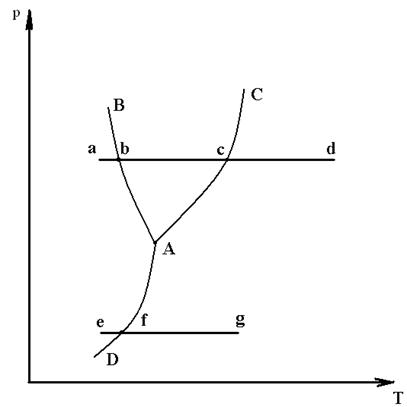
Рис. 2.2
Для изучения фазовых превращений вещества, используется диаграмма р-T (рис. 2.2), в которой по оси абсцисс – отложена температура, а на оси ординат давление - р. При этом точка а – изображает исходное состояние вещества, взятое в твердой фазе.
Процесс изобарного подвода теплоты с переходом вещества в жидкое и газообразное состояние, изобразится линией a-b-c-d. На которой можно выделить: участок «a-b» - нагрев твердой фазы до расплавления; участок «b-c» - нагрев жидкой фазы до температуры кипения; участок «c-d» - нагрев газовой фазы.
Отсюда можно заключить, что точка b соответствует двухфазной системе «твердое тело - жидкость», точка с – тоже «жидкость - пар». С увеличением давления точка b и точка с – расходятся, т.е. температура плавления уменьшается, а температура кипения увеличивается. И наоборот, с уменьшением давления точка b и точка с – сближаются. При более низких давлениях наблюдается переход из твердого состояния в газообразное происходит по линии e-f-g, минуя превращение вещества в жидкость, здесь точка f соответствует двухфазной системе «твердое тело-газ», такой процесс называется сублимацией или возгонкой.
Из анализа фазовой диаграммы, видно, что площадь, расположенная слева линии В-А-Д, характеризует твердую фазу; площадь, расположенная выше линии В-А-С – жидкую фазу; площадь, расположенная правее линии С-А-Д -газовую фазу. Точка А, соответствующая состоянию вещества во всех трех фазах, называется тройной точкой. Каждое вещество в тройной точке имеет строго определенные значения параметров: рк, Тк, vк.
В соответствии с решением международной конференции по свойствам водяного пара, тройная точка принята за начало отсчета внутренней энергии воды и водяного пара, т.е. Ua=0, Sa=0.
Значение энтальпии воды в тройной точке составляет
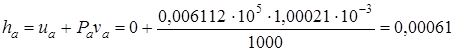 .
.
Столь высокая точность в практических расчетах не используется, поэтому принимают hа=0.
Различают однокомпонентную систему, в состав которой входят различные фазы одного и того же вещества и многокомпонентную систему, в состав которой входят химические разнородные вещества. Например, газовые смеси, кислоты, соли и т.д.
Процессы плавления металлов и сплавов сопровождаются фазовыми переходами и наличием движущейся границы раздела твердой и жидкой фаз. Для чистых кристаллических веществ эта граница характеризуется точкой плавления, а для сплавов граница превращается в двухфазную область определенной толщины, имеющая некоторый температурный переход.
При этом процесс плавления рассматривается как нагрев двухслойной пластины, состоящей из плавящегося слоя и твердого остатка. Для определения плотности теплового потока, расходуемого на нагрев твердого остатка и в дальнейшем времени плавления двухслойной пластины вводится понятие эффективной теплоемкости плавящегося слоя, которая определяется из выражения:
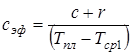 , (2.3)
, (2.3)
где с – удельная теплоемкость вещества, r – скрытая теплота плавления, Тпл – температура наружной поверхности плавящегося слоя, Тср1 – средняя температура плавящегося слоя определится по формуле:
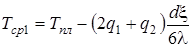 . (2.4)
. (2.4)
Тогда выражение для эффективной теплоёмкости будет иметь вид:
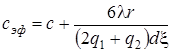 , (2.5)
, (2.5)
где λ – коэффициент теплопроводности вещества, q1 – плотность теплового потока подводимого к двухслойной пластине, q2 –плотность отводимого внутрь твердого тела теплового потока, d ξ – толщина плавящегося слоя.
Теплоемкость твердого тела зависит только от температуры и не зависит от давления. Значения теплоёмкостей металлов и сплавов для различных интервалов температур приводится в справочных таблицах.
 2014-02-24
2014-02-24 2549
2549
