Глава III
Глава II
Глава I
Строение металлов
§ 1. Материаловедение как наука о свойствах металлов и сплавов.
 Материаловедение – наука, изучающая металлические и неметаллические материалы, применяемые в технике, объективные закономерности зависимости их свойств от химического состава, их структуры, способов обработки и условий эксплуатации.
Материаловедение – наука, изучающая металлические и неметаллические материалы, применяемые в технике, объективные закономерности зависимости их свойств от химического состава, их структуры, способов обработки и условий эксплуатации.
Целью изучения данной дисциплины является познание природы и свойств материалов, а также методов их упрочнения для наиболее эффективного использования в технике.
Теоретической основой материаловедения являются соответствующие разделы физики и химии, однако наука о материалах в основном развивается экспериментальным путём. Поэтому разработка новых методов исследования строения и физико-механических свойств материалов способствует дальнейшему развитию материаловедения.
Изучение технологических, эксплуатационных свойств материалов позволяет определить области рационального их использования с учетом экономических требований.
Использование неметаллических материалов в промышленности невелико и составляет около 5 - 6 %. Хотя в последнее время ведутся работы по более широкому их использованию, однако металлы всё же занимают ведущее место. Поэтому в изучаемом курсе основное внимание будет уделено металлам и их сплавам.
§ 2. История развития науки.
Первое определение металлов, как тел “светлых, способных коваться”, дал в 18 веке гениальный русский ученый Михаил Васильевич Ломоносов.
 Выдающимся металлургом 19 века был Павел Петрович Аносов, который, работая на Златоустовском заводе, так поставил производство клинковой стали, что она превзошла прославленную сталь дамасских мастеров. П. П. Аносов первый в 1831 г. применил микроскоп для исследования металлов и подробно описал результаты своей работы в книге “О булатах”. Кроме того, П. П. Аносов разработал принципиально новый
Выдающимся металлургом 19 века был Павел Петрович Аносов, который, работая на Златоустовском заводе, так поставил производство клинковой стали, что она превзошла прославленную сталь дамасских мастеров. П. П. Аносов первый в 1831 г. применил микроскоп для исследования металлов и подробно описал результаты своей работы в книге “О булатах”. Кроме того, П. П. Аносов разработал принципиально новый  процесс газовой цементации, являющийся одним из наиболее прогрессивных и производительных методов науглероживания стали; он изучал также
процесс газовой цементации, являющийся одним из наиболее прогрессивных и производительных методов науглероживания стали; он изучал также  влияние на свойства стали различных инструментов.
влияние на свойства стали различных инструментов.
К середине 19 в., когда сталелитейное производство начало развиваться усиленными темпами и сталь начали применять для ответственных изделий (орудийные стволы и др.), выяснилось что свойства стальных изделий, изготовленных из стали одинакового состава, получаются различными. В одних случаях стальные изделия надёжно работали, в других – изделия из стали такого же состава оказывались совершенно непригодными. Причины этого были совершенно неясны, что ставило под сомнение возможность дальнейшего развития производства из стали ответственных деталей.
В этот период (1866 г.) начал свою работу на Обуховском заводе выдающийся русский ученый Дмитрий Константинович Чернов. Ему в течении 2-х лет непрерывной работы на заводе удалось сделать открытия мирового значения, которые обеспечили большой технический прогресс. Об этих открытиях, ставших основой металловедения как науки, Д. К. Чернов в апреле 1868 г. сообщил Русскому металлургическому обществу в своём докладе.
Д. К. Чернов впервые показал, что для стали в твёрдом состоянии существуют критические температуры (наз. точками Чернова), при которых изменяется строение стали, что приводит сталь к новому качественному состоянию.
Эти критические температуры являются ориентирами для построения правильных техпроцессов тепловой обработки, обеспечивающих высокое качество металлических изделий.
Только на основе открытия Чернова стал возможным дальнейший технический прогресс в машиностроении. Во всём мире производство стальных изделий, а впоследствии и изделий из других сплавов, построено на научных основах, созданных Д. К. Черновым.
Развитию металловедения в 19 в. также способствовали работы А. А. Байкова, Ф. Осмонда (Франция), Г. Таммана (Германия) Р. Аустена (Англия), Г. Хоу (США) и др.
За годы советской власти открыта большая сеть научно-исследователь-ских институтов, работающих в области металловедения и термообработки. Во многих учебных институтах имеются кафедры и лаборатории металлове-дения, на базе которых выросли крупные научные школы. Так школой академика Н. С. Курнакова изучено большое число металлических систем и установленна зависимость свойств сплавов от состава сплавов, а также связь между составом сплавов и технологическими свойствами сплавов. Школой академика А.А Бочвара открыты закономерности эвтектической и эвтектоидной кристаллизации.
Школой профессора С. С. Штейнбега изучены механизм и кинетика изотермического распада в стали.
Школой академика Г. В. Курдюмова рассмотрены природа и механизм образования мартенсита в стали и цветных сплавах и превращения при отпуске закаленной стали.
§ 3. Классификация металлических и
неметаллических материалов.
Все металлы и сплавы принято делить на 2 группы:
- железо и его сплавы (сталь, чугун) называют чёрными металлами;
- остальные металлы (Ве, Мg, Al, Ti, Cr, V, Mn, Co, Ni, Cu, Zn, Zr, Nb, Mo, Ag, Sn, W, Au, Hg, Pb, и др.) их сплавы - цветными.
Наибольшее применение нашли чёрные металлы. На основе железа изготовляется не менее 90 % всех конструкционных и инструментальных материалов. По сравнению с цветными металлами стоимость железа и его сплавов невелика.
Цветные металлы по сходным свойствам подразделяются на:
- лёгкие металлы (Be, Mg, Ai, Ti), обладающие малой плотностью;
- легкоплавкие металлы (Zn, Cd, Sn, Sb, Hg, Pb, Bi);
- тугоплавкие металлы (Ti, Cr, Zr, Nb, Mo, W, V), с температурой плавления выше, чем у железа;
- благородные металлы (Rh, Pb, Ag, Os, Pt, Au),обладающие химической инертностью;
- урановые металлы (U, Th, Pa), используемые в атомной технике;
- щелочноземельные металлы (Li, Ka, N, Be, Mg, Ca, Sr, Ba, Ra), используемые в атомных реакторах и др.
Понятие неметаллические материалы включают большой ассортимент материалов таких, как пластмассы, резиновые материалы, клеи, лакокрасочные покрытия, древесина, а также силикатные стёкла, керамика и др.
Неметаллические материалы являются не только заменителями металлов, но и применяются как самостоятельные, иногда даже незаменимые материалы. Отдельные материалы обладают высокой механической прочностью, лёгкостью, термической и химической стойкостью, высокими изоляционными характеристиками, оптической прозрачностью. Особенно важным свойством неметаллических материалов является их технологичность.
Применение неметаллических материалов обеспечивает значительную экономическую эффективность.
§ 4. Методы исследования металлов и сплавов.
В материаловедении используют разнообразные методы исследований и испытаний, необходимые для получения достаточно полной и надёжной информации о свойствах металлов и полимеров и об изменении их в зависимости от состава, структуры и обработки. Эти многочисленные и отличающиеся между собой методы исследований можно разделить на 2 группы:
1. Методы, с помощью которых определяют строение и превращения, протекающие в материалах и изменяющие их строение.
Для лучшей характеристики этих методов нужно в свою очередь различать:
А) методы, использование которых позволяет непосредственно наблюдать или определять строение металлов и которые называют структурными. К ним относятся:
- металлографический, который подразделяется на макроскопичес-кий (макроанализ) и микроскопический (микроанализ)
- рентгеноструктурный, который позволяет определить атомно-кристаллическое строение металлов.
Б) методы, основанные на существовании связи между строением и свойствами материалов. Они позволяют косвенно, но достаточно надёжно, судить о превращениях, протекающих в металлах при их обработке и воздействующих на их структуру, по изменению их физических свойств. К ним относятся:
- термический анализ – определение критических температур при охлаждении и нагревании сплавов;
- дилатометрический – определение коэффициентов теплового расширения и изменения объёма;
- Электросопротивления;
- Магнитный;
- Метод радиоактивных изотопов.
2. Методы, использование которых позволяет непосредственно определять свойства материалов, требуемые в тех или иных условиях эксплуатации.
К ним прежде всего относятся механические методы, которые позволяют определить следующие механические свойства:
- твёрдость;
- предел прочности на растяжение;
- предел прочности на сжатие;
- предел прочности на изгиб;
- предел прочности на кручение;
- предел выносливости;
- испытание на усталость;
- относительное удлинение;
- ударную вязкость; и др.
Иногда кроме механических свойств, определяют некоторые физические (коэффициент теплового расширения, плотности, коэрцитивной силы, магнитной проницаемости) и ряда химических свойств (электрохимического потенциала, стойкости против коррозии в разных агрессивных средах и др.)
§ 5. Типы связей в металлических телах.
Металлический тип связи
В природе существуют две разновидности тел, различающиеся по своим свойствам, - кристаллические и аморфные.
Кристаллические тела остаются твердыми, т. е. сохраняют приданную форму до вполне определенной температуры, при которой они переходят в жидкое состояние. При охлаждении процесс идёт в обратном направлении. Переход из одного состояния в другое протекает при определенной температуре плавления.
Аморфные тела при нагреве размягчаются в большом температурном интервале, становятся вязкими, а затем переходят в жидкое состояние. При охлаждении процесс идёт в обратном порядке.
Кристаллическое строение твёрдого тела более стабильное, чем аморфное.
Аморфные тела в отличие от жидкостей имеют пониженную подвижность частиц. Аморфное состояние можно зафиксировать во многих неорганических и органических веществах ускоренным охлаждением из жидкого состояния.
Кристаллические тела характеризуются упорядоченным расположением в пространстве элементарных частиц, из которых они составлены (ионов, атомов, молекул).
Свойства кристаллов зависят от электронного строения атомов и характера взаимодействия их в кристалле; от пространственного расположения элементарных частиц; химического состава, размера и формы кристаллов.
Тип связи, возникающий между элементарными частицами в кристалле, определяется электронным строением атомов, вступающих во взаимодействие. Элементарные частицы в кристалле сближаются на определённое расстояние, которое обеспечивает кристаллу наибольшую термодинамическую стабильность, Расстояние на которое сближаются частицы, определяется взаимодействием сил, действующих в кристалле.
Силы притяжения возникают благодаря взаимодействию электронов с положительно заряженным ядром собственного атома, а также с положительно заряженными ядрами соседних атомов.
Силы отталкивания возникают в результате взаимодействия положительно заряженных ядер соседних атомов при их сближении.
Силы отталкивания проявляются при сильном сближении и растут интенсивнее, чем силы притяжения.
Уравновешивание сил происходит при сближении элементарных частиц на определённое расстояние d0. Этому сближению соответствует min энергии связи Есв, что делает кристалл термодинамически стабильным. Она определяет температуры плавления, испарения, модуль упругости, температурный коэффициент линейного расширения и др.
Все кристаллы по характеру превалирующей связи подразделяют на молекулярные, ковалентные, металлические и ионные.
Молекулярные кристаллы часто в нормальных условиях – газы. Они являются диэлектриками, т. к. кристалл построен из электрически нейтральных атомов, у которых энергетические зоны полностью достроены.
Ковалентные кристаллы – в них преобладает ковалентный тип связи. Это кристаллы из атомов углерода, кремния, германия, сурьмы и др.
Металлические кристаллы имеют металлический тип связи. Они электроположительные.
Металлам присущ металлический тип связи. Внешние электроны легко могут покинуть свой атом и перейти к соседнему, и таким образом, перемещаясь между ионами, образуют свободный электронный газ, принадлежащий всему комплексу атомов. При сближении атомов происходит переход электронов с внешних орбит одного атома на внешние орбиты другого, т. е. возникает взаимодействие электронов внешних оболочек, которые создают связь между атомами металла (силы сцепления). В результате этого сцепления образуются кристаллические решетки, состоящие из ионов, удерживающих друг возле друга электронным газом.
Ионные кристаллы. В сложных кристаллах, состоящих из элементов различной валентности, возможно образование ионного типа связи. Представитель этой группы – кристалл оксида FeO, решётка которого состоит из отрицательно заряженных ионов кислорода и положительно заряженных ионов железа.
§ 6. Атомно-кристаллическое строение металлов.
Типы кристаллических решёток.
Под атомно-кристаллической структурой понимают взаимное расположение атомов, существующее в кристалле. Кристалл состоит из атомов(ионов), расположенных в определённом порядке, который периодически повторяется в трёх измерениях.
Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решётки.
Кристаллическая решётка представляет собой воображаемую пространственную сетку, в узлах которой располагаются атомы(ионы), образующие металл.
Наибольший объём кристалла, дающий представление об атомной структуре металла во всём объёме, наз. элементарной кристаллической ячейкой.
Кристаллические решётки металлов могут быть разных типов.
Кристаллические решётки, в которых на долю одной элементарной ячейки приходится один атом, наз. простыми. Решётки, в которых на долю одной элементарной ячейки приходится несколько атомов, наз. сложными.
Металлы образуют следующие сложные решётки:
- кубическую объёмно-центрированную (ОЦК)
- кубическую гранецентрированную (ГЦК)
- гексагональную плотноупакованную (ГПУ).
В кубической объёмно-центрированной решётке атомы расположены в узлах ячейки и один атом в центре куба.
 Эту решётку имеют следующие металлы:
Эту решётку имеют следующие металлы:
K, Na, Li, W, V, Feα, Cr, Ba, и др.
В кубической гранецентрированной решётке атомы расположены в узлах решётки и в центре каждой грани.
 Эту решётку имеют следующие металлы:
Эту решётку имеют следующие металлы:
Ca, Pb, Ni, Ag, Au, Feγ, Cu, Coα, и др.
В гексагональной решётке атомы расположены в узлах, центре шестигранных оснований призмы и три атома в средней части призмы.
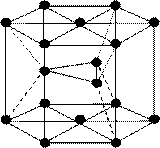 Эту решётку имеют следующие металлы:
Эту решётку имеют следующие металлы:
Mg, Ti, Cd, Zn, Coβ, Be, Caα, и др.
Размеры кристаллической решётки характеризуются величинами периодов, под которыми понимают расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку.
Период или параметр решётки измеряется в ангстремах (1А0=10-8 см) и находится в пределах от 1 до 7 А0.
Параметры кубических решёток характеризуются длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решётки принимают два параметра – сторону шестигранника а и высоту призмы с.
Плотность кристаллической решётки, т. е. объём, занятый атомами, характеризуется координационным числом, под которым понимают число атомов, находящихся на равном и наименьшем расстоянии от данного атома.
В ОЦК от данного атома в центре куба на равном расстоянии находится 8 атомов. Координационное число К8, коэффициент заполнения ячейки, определяемый как отношение объёма, занятого атомами, к объёму ячейки составляет 68%.
В ГЦК от атома в центре грани на равном расстоянии находится 12 атомов – К12 (4 в узлах и 8 в центре граней двух решёток).
В ГПУ также 12 от центрального в основании (по 3 в центре и 6 в основании ячеек) К12.
ГЦК и ГПУ – (с/а=1,633) – решётки наиболее компактные, в них коэффициент заполнения объёма атомами равен 74%.
В каждой решётке можно определить количество атомов, приходящихся на каждую элементарную ячейку:
ОЦК – 2 атома (один в центре куба, в узлах решётки каждый атом приходится на 8 ячеек, поэтому на каждую ячейку приходится 1/8 8+1=1+1=2).
8+1=1+1=2).
ГЦК – 4 атома(1/8 8=1+3 атома в центре граней, т. к. каждая грань принадлежит двум ячейкам).
8=1+3 атома в центре граней, т. к. каждая грань принадлежит двум ячейкам).
ГПУ – 6 атомов(3 в центре + 1/6 12 в узлах + 1/2
12 в узлах + 1/2 2 в центре оснований = 6).
2 в центре оснований = 6).
§ 7. Анизотропия свойств металлов.
Плотность расположения атомов по различным плоскостям неодинакова. Вследствие этого в различных плоскостях и направлениях решётки многие свойства(химические, физические, механические) каждого кристалла зависят от направления решётки.
Подобная неодинаковость свойств монокристалла в разных кристаллографических направлениях наз. анизотропией.
Все кристаллы анизотропны. В отличие от кристаллов, аморфные тела(стекло) в различных направлениях имеют в основном одинаковую плотность упаковки атомов и поэтому одинаковые свойства в различных направлениях. Аморфные тела изотропны.
Технические металлы состоят из большого количества по разному ориентированных мелких анизотропных кристаллов и являются поликрис-таллами. Кристаллы неупорядоченно ориентированы один по отношению к другому и поэтому свойства во всех направлениях получаются усред-нёнными (одинаковыми). Эта кажущаяся независимость свойств от направления наз. квазиизотропией (мнимая изотропность).
Такая мнимая изотропность металла не будет наблюдаться, если все кристаллиты имеют одинаковую ориентировку в каком-то направлении. Эта ориентированность или текстура создаётся в результате значительной холодной деформации, например прокатки. Тогда поликристаллический металл приобретает анизотропию свойств (вдоль и поперёк прокатки).
§ 8. Особенности кристаллического строения реальных кристаллов.
Виды несовершенств.
Реальный кристалл, в отличие от идеального, всегда имеет структурные несовершенства или дефекты. Дефекты кристаллического строения подразделяют по геометрическим признакам на три типа:
- точечные (нуль-мерные), - размеры которых малы во всех трёх измерениях;
- линейные – размеры которых малы в двух направлениях (одномерные);
- поверхностные – размеры которых малы только в одном измерении (двухмерные).
К точечным дефектам относятся вакансии или “дырки” (дефекты Шотки), т.е. узлы решётки, в которых атомы отсутствуют. Это происходит потому, что атомы колеблются возле точек равновесия (узлов решётки) и чем выше температура, тем больше амплитуда колебаний. В кристалле всегда имеются атомы, которые обладают энергией, значительно превышающей среднюю. Такие атомы имеют не только амплитуду колебаний больше, чем средняя, но и они могут ещё перемещаться с одного места в другое (например из узла в междоузлие, из грани кристалла наружу).
Вышедший из узла решётки атом наз. дислоцированным. Место, где находился такой атом, остаётся в решётке незаполненным, оно наз. вакансией.
При данной температуре в кристалле образуются не только одиночные вакансии, но и двойные, тройные и т.д.
Вакансии образуются и в процессе пластической деформации, а также при бомбардировке металла атомами или частицами высоких энергий(в атомном реакторе).
Межузельные атомы (дефекты Френкеля) образуются в результате перехода атома из узла решётки в междоузлие. В плотноупакованных решётках, характерных для большинства металлов, энергия образования межузельных атомов в несколько раз больше энергии образования тепловых вакансий. Поэтому вакансии в таких кристаллах являются основными точечными дефектами.
Точечные дефекты вызывают местное искажение кристаллической решётки. Они оказывают влияние на некоторые физические свойства металла (электропроводимость, магнитные свойства) и предопределяют процессы диффузии в металлах и сплавах.
Линейные дефекты. К линейным несовершенствам относятся дислока-ции, которые бывают краевые и винтовые.
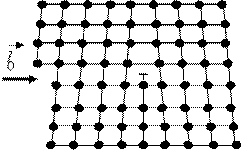
Краевая дислокация представляет собой локализованное искажение кристаллической решётки, вызванное наличием в ней “лишней” атомной полуплоскости или экстраплоскости, перпендикулярной к плоскости чертежа.
|
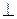 вектору сдвига.
вектору сдвига.
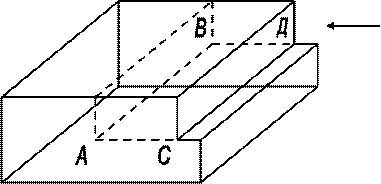 |
Рис. Сдвиг, создавший краевую дислокацию
 | |||
 | |||
 - положительная дислокация
- положительная дислокация
 - отрицательная дислокация
- отрицательная дислокация
Рис. Схемы расположения атомов у дислокации.
Кристаллическая решётка вокруг дислокации упруго искажена на несколько атомных расстояний. Длина линии дислокации может составлять несколько тысяч параметров решётки.
Винтовые дислокации. В отличие от краевых расположены параллельно направлению сдвига. При наличии винтовой дислокации кристалл можно рассматривать как состоящий из одной атомной плоскости, закрученной в виде винтовой поверхности.
Образование дислокаций может происходить в процессе кристаллизации, при пластической деформации, термической обработке и др. процессах. С помощью дислокаций можно объяснить многие явления, связанные с прочностью металлов, особенностями фазовых превращений, протекающих в сплавах, и др. явления.
Поверхностные дефекты. Эти несовершенства связанны с границами зерен. На границе между зернами атомы имеют менее правильное расположение, чем в объёме зёрна. Каждое зерно металла состоит из отдельных блоков или субзёрен, образующих так называемую мозаичную структуру или субструктуру. Зёрна металла разориентированы относительно друг друга на величину, достигающую от нескольких долей градуса до нескольких градусов или их десятков.
Блоки, или субзёрна, также повёрнуты по отношению друг другу на угол от несколько секунд до нескольких минут. В пределах каждого блока решётка почти идеальная, если не считать точечных дефектов. По границам зёрен скапливаются дислокации, а также примеси и включения. По границам зёрна расположены менее правильно, т. к. решётка одного кристалла, имеющего определённую кристаллографическую ориентацию, переходит в решётку другого кристалла, имеющего другую кристаллографическую ориентацию.
С увеличением угла разориентировки блоков или субзёрен и уменьшения их величины плотность дислокаций в металле увеличивается. Вследствие того, что в реальном поликристаллическом металле протяжённость границ блоков и зёрен очень велика, количество дислокаций в таком металле огромно (104 – 1012 см-2).
§ 8. Диффузия.
Многие процессы, протекающие в металлах и сплавах (процесс кристаллизации, фазовые превращения, рекристаллизация, процессы насыщения поверхности другими компонентами), носят диффузионный характер.
Под диффузией понимают перемещение атомов в кристаллическом теле на расстояние, превышающие средние межатомные расстояния данного вещества.
Если перемещения атомов не связанны с изменением концентрации в определённых объёмах, то такой процесс наз. самодиффузией.
Перемещение атомов, сопровождающееся изменением концентрации, происходит в сплавах или в металлах с повышенным содержанием примесей и наз. диффузией или гетеродиффузией.
В основе процесса диффузии в кристаллах лежит атомный механизм, при котором каждый атом совершает более или менее случайные блуждания, т. е. ряд скачков между различными равновесными положениями в решётке.
Для описания процесса диффузии в твёрдом кристаллическом теле существуют несколько возможных механизмов: циклический, обменный, вакансионный и межузельный.
В металлах диффузия преимущественно осуществляется по вакансионному механизму. На место вакансии 1 может переместиться атом 2, обладающий повышенной энергией. Вакансия окажется на бывшем месте этого атома, и её может занять атом 3 и т.д. Энергия активации диффузии характеризует энергию связи атомов в кристаллической решётке. Чем выше её значение, тем больше величина энергии, необходимой для перехода атомов из одного равновесного положения, в другое, тоже равновесное. Требуемый для такого перехода избыток энергии приобретается атомом благодаря тому, что атомы непрерывно обмениваются кинетической энергией.
Наиболее полно диффузия протекает по поверхности и границам зёрен, где сосредоточены дефекты кристаллического строения (вакансии, дислокации).
§ 9. Кристаллизация металлов.
Переход металла из жидкого или парообразного состояния в твёрдое с образованием кристаллической структуры наз. первичной кристаллизацией.
Образование новых кристаллов в твёрдом кристаллическом веществе наз. вторичной кристаллизацией.
Процесс кристаллизации состоит из двух одновременно идущих процессов – зарождения и роста кристаллов.
Кристаллы могут зарождаться самопроизвольно (самопроизвольная кристаллизация) или расти на имеющихся готовых центрах кристаллизации (несамопроизвольная кристаллизация).
Самопроизвольная кристаллизация обусловлена стремлением вещества иметь более устойчивое состояние, характеризуемое меньшей свободной энергией или термодинамическим потенциалом, т. е. когда свободная энергия кристалла меньше свободной энергии жидкой фазы.
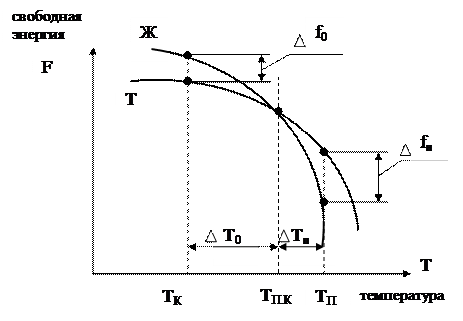
Изменение свободной энергии жидкого и твёрдого состояния в зависимости от температуры приведено на рисунке:
 Кристаллизация Плавление
Кристаллизация Плавление
 Т0 – степень переохлаждения
Т0 – степень переохлаждения
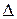 Т0=ТП.К. – ТК.
Т0=ТП.К. – ТК.
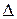 ТП - степень перенагрева
ТП - степень перенагрева
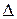 ТП=ТП – ТП.К
ТП=ТП – ТП.К
Выше температуры ТП.К более устойчив жидкий металл, имеющий меньший запас свободной энергии, а ниже этой температуры устойчив твёрдый металл. При температуре ТП.К. величины свободных энергий жидкого и твёрдого состояний равны. Температура ТП.К. соответствует равновесной температуре кристаллизации (или плавления) данного вещества, при которой обе фазы (жидкая и твёрдая) могут существовать одновременно и при том бесконечно долго. Процесс кристаллизации при данной температуре ещё не начинается. Процесс кристаллизации развивается, если созданы условия, когда возникает разность свободных энергий 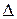 f0, образующаяся вследствие меньшей свободной энергии твёрдого металла по сравнению с жидким.
f0, образующаяся вследствие меньшей свободной энергии твёрдого металла по сравнению с жидким.
Следовательно, процесс кристаллизации может протекать только при переохлаждении металла ниже равновесной температуры ТП.К.. Разность между температурами ТП.К. и ТК, при которых может протекать процесс кристаллизации, носит название степени переохлаждения
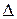 Т=ТП.К. – ТК.
Т=ТП.К. – ТК.
Термические кривые, характеризующие процесс кристаллизации чистых металлов при охлаждении с разной скоростью V, даны на рисунке:
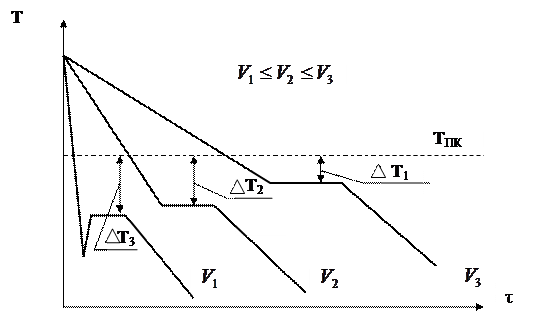 |

При очень медленном охлаждении (V1) степень переохлаждения 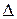 Т1 невелика и процесс кристаллизации протекает при температуре, близкой к равновесной. На термической кривой при температуре кристаллизации отмечается горизонтальная площадка (остановка в падении температуры), образование которой объясняется выделением скрытой теплоты кристаллизации, несмотря на отвод теплоты при охлаждении.
Т1 невелика и процесс кристаллизации протекает при температуре, близкой к равновесной. На термической кривой при температуре кристаллизации отмечается горизонтальная площадка (остановка в падении температуры), образование которой объясняется выделением скрытой теплоты кристаллизации, несмотря на отвод теплоты при охлаждении.
С увеличением скорости охлаждения степень переохлаждения возрастает (V2 и V3) и процесс кристаллизации протекает при температурах, лежащих значительно ниже равновесной температуры кристаллизации.
Степень переохлаждения зависит от природы и чистоты металла. Чем чище жидкий металл, тем более он склонен к переохлаждению. При затвердевании очень чистых металлов степень переохлаждения 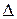 Т может быть очень велика. У свинца например 80ºС, а у никеля – 319ºС, Co – 330ºС, Fe – 29ºС (при больших скоростях охлаждения). Обычная степень переохлаждения металлов при кристаллизации в производственных условиях колеблется от 10 до 30º.
Т может быть очень велика. У свинца например 80ºС, а у никеля – 319ºС, Co – 330ºС, Fe – 29ºС (при больших скоростях охлаждения). Обычная степень переохлаждения металлов при кристаллизации в производственных условиях колеблется от 10 до 30º.
Степень перенагрева при плавлении металлов. Как правило, не превышает нескольких градусов.
§ 10 Механизм процесса кристаллизации.
Процесс кристаллизации, как впервые установил в 1878 г. Д. К. Чернов, начинается с образования кристаллических зародышей (центров кристаллизации) и продолжается в процессе роста их числа и размеров.
В жидком состоянии атомы вещества, вследствие теплового движения, перемещаются беспорядочно. В то же время в жидкости имеются группировки атомов небольшого объёма, в пределах которых расположение атомов вещества во многом аналогично их расположению в решётке кристалла. Эти группировки неустойчивы, они рассасываются и вновь появляются в жидкости. При переохлаждении жидкости некоторые из них, наиболее крупные, становятся устойчивыми и способными к росту. Эти устойчивые группировки атомов наз. центрами кристаллизации (зародыша-ми).
Зародыши, возникающие в процессе кристаллизации, могут быть различной величины. Рост зародышей возможен только при условии, если они достигли определённой величины, начиная с которой их рост ведёт к уменьшению свободной энергии.
В процессе кристаллизации свободная энергия системы, с одной стороны, уменьшается, вследствие перехода некоторого объёма жидкого металла в твёрдый, а с другой стороны, возрастает в результате образования поверхности раздела с избыточной поверхностной энергией.
Минимальный размер зародыша, способного к росту при данных температурных условиях, наз. критическим размером зародыша, а сам зародыш критическим, или равновесным.
При температуре, близкой к T П.К размер критического зародыша должен быть очень велик и вероятность его образования очень мала.
С увеличением степени переохлаждения величина  f возрастает, а величина поверхностного натяжения на границе раздела фаз изменяется незначительно.
f возрастает, а величина поверхностного натяжения на границе раздела фаз изменяется незначительно.
С увеличением степени переохлаждения (или с понижением температуры кристаллизации) размер критического зародыша уменьшается и будет меньше работа, необходимая для его образования. В связи с этим, с увеличением степени переохлаждения, когда становятся способными к росту зародыши всё меньшего размера, сильно возрастает число зародышей или скорость их образования.
Рост зародышей кристаллизации происходит в результате перехода атомов из переохлажденной жидкости к кристаллам. Кристалл растёт послойно, при этом каждый слой имеет одноатомную толщину.
Пока образовавшиеся кристаллы растут свободно, они имеют более или менее правильную геометрическую форму. Однако при столкновении растущих кристаллов их правильная форма нарушается, т. к. в этих участках рост граней прекращается. Рост продолжается только в тех направлениях, где есть свободный доступ “питающей” жидкости. В результате растущие кристаллы, имевшие вначале геометрически правильную форму, после затвердевания получают неправильную внешнюю форму и поэтому наз. кристаллитами или зёрнами.
В растущем кристалле всегда имеются дислокации. В месте выхода на поверхность винтовой дислокации имеется ступенька, к которой легко присоединяются атомы, поступающие из жидкости.
§ 11. Число центров кристаллизации и скорость
роста кристаллов. Величина зерна.
Скорость процесса и окончательный размер кристаллов при затвердевании определяется соотношением скоростей роста кристаллов и образования центров кристаллизации.
Скорость образования зародышей измеряется числом зародышей, образующихся в единицу времени в единице объёма 1/см3 с (1 мм-3 с-1) ч. з.
Скорость роста зародышей – увеличением литейного размера растущего кристалла в единицу времени (мм/с) с.р.
Чем больше скорость образования зародышей и чем больше скорость их роста, тем быстрее протекает процесс кристаллизации. Оба процесса связаны с перемещением атомов и зависят от температуры.
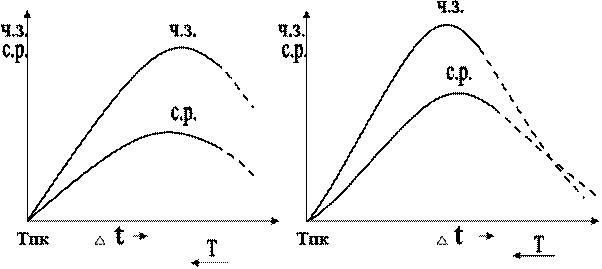 |
Рис. Схема зависимости ч. з. и с. р.,  f и v (средней скорости от кристаллизации) от степени переохлаждения
f и v (средней скорости от кристаллизации) от степени переохлаждения  t.
t.
При равновесной температуре кристаллизации ТП.К. число зародышей и скорость роста равны 0, поэтому кристаллизация не происходит. При увеличении степени переохлаждения скорость образования зародышей и скорость их роста возрастают, при определённой степени их переохлаждения достигает максимума, после чего снижаются. С увеличением степени переохлаждения скорость образования зародышей возрастает быстрее, чем скорость их роста.
Для металлов, которые в обычных условиях кристаллизации не склонны к большим переохлаждениям, как правило, характерны восходящие ветви кривых. Это значит, что при небольших величинах степени переохлаждения, когда велик размер критического зародыша, а скорость образования зародышей мала, при затвердевании формируется крупнокристаллическая структура.
Небольшие степени переохлаждения достигаются при заливке жидкого металла в форму с низкой теплопроводностью (земляная, шамотовая) или в подогретую металлическую форму.
Увеличение степени переохлаждения происходит при заливке жидкого металла в холодные металлические формы, а также при уменьшении толщины стенок отливки. Поскольку при этом скорость образования зародышей увеличивается более интенсивно, чем скорость их роста, получаются более мелкие кристаллы.
Величина зерна находится в следующей зависимости от числа зародышей и скорости роста: 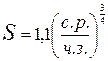
Размер зерна металла сильно влияет на его механические свойства. Эти свойства, особенно вязкость и пластичность, выше, если металл имеет мелкое зерно.
Величина зерна зависит не только от степени переохлаждения, но также и от температуры нагрева и разливки жидкого металла, его химического состава и особенно присутствия в нём посторонних примесей.
§ 12. Несамопроизвольная кристаллизация.
В реальных условиях процесс кристаллизации и характер образующейся структуры в значительной мере зависят от имеющихся готовых центров кристаллизации. Такими центрами, как правило, являются тугоплавкие частицы неметаллических включений, оксидов, интерметаллических соединений, образуемых примесями. К началу кристаллизации центры находятся в жидком металле в виде твёрдых включений. При кристаллизации атомы металла откладываются на активированной поверхности примеси, как на готовом зародыше. Такая кристаллизация наз. несамопроизвольной или гетерогенной. При такой кристаллизации роль зародышей могут играть и стенки формы.
Наличие готовых центров кристаллизации приводит к уменьшению размера кристаллов при затвердевании. Эффект измельчения структуры значительно увеличивается при соблюдении структурного и размерного соответствия примесной фазы с основным металлом (расхождение в межатомных размерах не должно превышать 5 – 7%, которое способствует сопряжению их кристаллических решёток).
Измельчение структуры способствует улучшению механических свойств металла.
На практике для измельчения структуры металлов и сплавов широко применяют технологическую операцию, наз. модифицированием. Она состоит в ведении жидкий сплав перед разливкой специальных добавок (модификаторов). В качестве модификаторов используют поверхностно-активные вещества (напр. бор в стали, Na в Al и его сплавах) и элементы, образующие тугоплавкие тонкодисперсные частицы (напр. титан, цирконий в Al; Al, Ti в стали, Mg для чугуна). Модификаторы добавляют в сплавы в количествах от тысячных до десятых долей %.
§ 13. Строение металлического слитка.
Форма и размер зёрен, образующихся при кристаллизации, зависят от условий их роста, главным образом от скорости и направления отвода теплоты и температуры жидкого металла, а также от содержания примесей. Чаще в процессе кристаллизации образуются разветвленные, или древовидные кристаллы, получившие наз. дендритов. Установлено, что максимальная скорость роста кристаллов наблюдается по таким плоскостям и направлениям, которые имеют наибольшую плотность упаковки атомов. В результате вырастают длинные ветви, которые наз. осями первого порядка. По мере роста на осях первого порядка появляются и начинают расти оси второго порядка 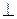 к первым, от которых ответвляются оси третьего порядка и т. д. В последнюю очередь идёт кристаллизация на участках между осями дендритов.
к первым, от которых ответвляются оси третьего порядка и т. д. В последнюю очередь идёт кристаллизация на участках между осями дендритов.
Дендриты растут до тех пор, пока соприкоснутся друг с другом. После этого окончательно заполняются межосные пространства, и дендриты превращаются в полновесные кристаллы с неправильной внешней огранкой (кристаллиты). При недостатке жидкого металла для заполнения межосных пространств (напр. на открытой поверхности или в усадочной раковине) кристалл сохраняет дендритную форму. Такой дендрит был обнаружен Черновым Д. К.
Условия отвода теплоты при кристаллизации значительно влияют на форму зёрен. Кристаллы растут преимущественно в направлении, обратном отводу теплоты. Поэтому при направленном теплоотводе образуются вытянутые (столбчатые) кристаллы. Если теплота отводится во всех трёх направлениях с приблизительно одинаковой скоростью, формируются равновесные кристаллы.
Структура слитка зависит от многих факторов, основные из которых следующие:
- количество и свойства примесей в чистом металле или легирующих элементов в сплаве;
- температура разливки;
- скорость охлаждения;
- конфигурация, температура, теплопроводность и состояние внутренней поверхности литейной формы.
Типичная структура слитка сплавов состоит из 3 зон:
1. зона мелких равновесных кристаллов (корки);
2. зона столбчатых кристаллов;
3. зона равновесных кристаллов больших размеров случайной ориентации;
4. усадочная раковина;
5. усадочные пустоты;
6. усадочная рыхлость.
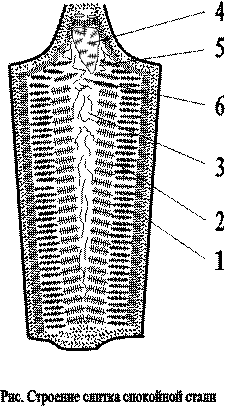 |
Жидкий металл прежде всего переохлаждается в местах соприкосновения с холодными стенками формы. Большая степень переохлаждения способствует образованию на поверхности слитка зоны 1 – мелких равноосных кристаллов.
Затем происходит преимущественный рост кристаллов, наиболее благоприятно ориентированных по отношению к теплоотводу. Образуется зона 2 – зона столбчатых кристаллов, расположенных нормально к стенкам формы. В средине слитка, где наблюдается наименьшая степень переохлаждения и не ощущается направленного отвода теплоты, образуются равноосные кристаллы больших размеров – зона 3.
Применяя различные технологические приёмы, можно изменить количественное соотношение зон или исключить из структуры слитка какую-либо зону вообще. Напр., перегрев сплавов перед разливкой и быстрое охлаждение при кристаллизации приводят к формированию структуры, состоящей практически из одних столбчатых кристаллов. Такая структура наз. транскристаллической. Подобную структуру имеют слитки очень чистых металлов. Зона столбчатых кристаллов характеризуется наибольшей плотностью, но в месте стыка столбчатых кристаллов собираются нерастворимые примеси, и слитки с транскристаллической структурой часто растрескиваются при обработке давлением.
В верхней части слитка, которая затвердевает в последнюю очередь, концентрируется усадочная раковина – 4. Под усадочной раковиной металл получается рыхлым, в нём содержится много усадочных пор – 5,6. Часть слитка с усадочной раковиной и рыхлым металлом отрезают.
§ 14. Аллотропия.
Аллотропией наз. возможность существования одного и того же вещества в различных кристаллических формах (Fe, Co, Ti, Sn и др.).
Аллотропические превращения сопровождаются выделением или поглощением тепла.
Существование вещества в различных кристаллических формах при разных температурах обуславливается его стремлением к состоянию с наименьшим запасом свободной энергии. Образование в этих условиях определённой кристаллической структуры означает, что для данной пространственной конфигурации атомов запас свободной энергии оказывается наименьшим.
Аллотропия имеет большое техническое значение. На использовании этого явления основаны способы упрочнения и разупрочнения, т. е. термическая обработка сплавов на основе Fe, Ti, имеющих важное значение в практике промышленного производства.
§ 15. Полиморфные превращения.
Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах или, как их называют, в разных полиморфных модификациях. В результате полиморфного превращения атомы кристаллического тела, имеющие решётку одного типа, перестраиваются таким образом, что образовывается кристаллическая решётка другого типа, Полиморфную модификацию при более низкой температуре, для большинства металлов принято обозначать 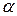 , затем
, затем 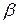 ,
, 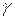 и т. д.
и т. д.
Полиморфное превращение протекает в том случае, если при данной температуре может существовать металл с иной кристаллической решёткой и меньшим запасом свободной энергии.
Переход чистого металла из одной полиморфной модификации в другую в условиях равновесия протекает при постоянной температуре (критическая точка) и сопровождается выделением теплоты при охлаждении, или поглощением при нагреве.
Полиморфное превращение по своему механизму – кристаллизацион-ный процесс, т. е. осуществляется путём образования зародышей и после-дующего их роста.
В результате превращения образуются новые кристаллические зёрна, имеющие другой размер и форму, поэтому такое превращение наз. перекристаллизацией.
Полиморфные превращения проходят не только в чистых металлах, но и в сплавах. Полиморфные превращения сопровождаются скачкообразным изменением всех свойств: удельного объёма, теплоемкости, тепло-электро-проводности, магнитных свойств, механических и химических свойств.
Теория сплавов.
§ 1. Сплав, система, компонент, фаза.
Под металлическим сплавом понимают вещество, получаемое сплавлением двух или более элементов с характерными металлическими свойствами.
При образовании сплава должна существовать диффузия элементов, т. е. взаимное проникновение их частиц с образованием новых однородных тел, наз. фазами
Сплавы состоят из двух или более элементов периодической системы.
Элементы, образующие сплав, наз. компонентами.
Совокупность фаз, находящихся в определённом состоянии при данной температуре, наз. системой.
Фаза, это независимая часть системы, имеющая постоянный состав, строение и свойства, а также границу раздела с другими фазами.
Обычно сплавы получают путём сплавления элементов в жидком состоянии. Но можно некоторые сплавы получать другими методами: порошковой металлургией, плазменным напылением, электролизом и др. методами.
§ 2. Фазы в металлических сплавах.
В зависимости от физико-химического взаимодействия компонентов в сплавах могут образовываться следующие фазы: жидкие растворы, твёрдые растворы, химические соединения.
В жидком состоянии большинство металлов неограниченно растворяются друг в друге, образуя однофазный жидкий раствор. Не растворяются взаимно в жидком состоянии металлы с большой разницей в объёмах атомов и температурах плавления: напр. железо со свинцом, медь со свинцом, которые образуют два несмешивающихся жидких слоя.
При кристаллизации могут образовываться твёрдые растворы.
Твёрдыми растворами наз. фазы, в которых сохраняется решётка одного компонента – растворителя, а атомы другого располагаются в ней, изменяя её размеры.
Таким образом, твёрдый раствор, состоящий из двух или более компонентов, имеет один тип решётки и представляет собой одну фазу.
Твёрдые растворы являются кристаллическими фазами переменного состава. Атомы растворённого элемента В размещаются в кристаллической решётке растворителя – элемента А, либо замещая атомы в узлах решётки, либо внедряясь в междоузлие. В первом случае кристаллы наз. твёрдыми растворами замещения, во втором - твёрдыми растворами внедрения.
Количество замещённых атомов, также как и количество внедрённых, может изменяться в широких пределах, что приводит к переменной растворимости твёрдых растворов.
Растворимость может быть неограниченной для твёрдых растворов замещения и ограниченной – для тех и других. Твёрдые растворы обозначаются буквами 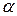 ,
, 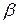 ,
, 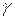 и т.д. или А(В) – где А – растворитель, В – растворенный элемент.
и т.д. или А(В) – где А – растворитель, В – растворенный элемент.
Твёрдые растворы замещения.
При образовании твёрдого раствора замещения, атомы растворённого компонента замещают часть атомов растворителя в его кристаллической решётке.
 Вокруг атома растворённого компонента возни-кают местные искажения кристаллической решётки, что приводит к изменению свойств.
Вокруг атома растворённого компонента возни-кают местные искажения кристаллической решётки, что приводит к изменению свойств.
Образование твёрдых растворов всегда сопровож-дается увеличением твёрдости и прочности, уме-ньшением пластичности, увеличением электросопро-тивления по сравнению с чистыми металлами.
При образовании твёрдых растворов замещения возможна и неограниченная растворимость элементов в твёрдом состоянии.
Для этого должны соблюдаться следующие условия:
1. компоненты должны обладать одинаковыми по типу кристаллическими решётками;
2. различие в атомных размерах компонентов не должно превышать 8 – 15%:
3. компоненты должны принадлежать одной и той же группе периодической системы или к смежным родственным группам.
Неограниченная растворимость в твёрдом состоянии наблюдается в сплавах меди с никелем, меди с золотом, Fe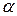 c хромом, Fe
c хромом, Fe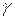 с никелем
с никелем
Многие твёрдые растворы замещения при относительно невысоких температурах способны находиться в упорядоченном состоянии, т. е. когда атомы одного и другого металла размещаются в совершенно определённом порядке. Такие твёрдые растворы наз. упорядоченными или сверхструктурой.
Переход в упорядоченное состояние происходит при определённой температуре или в интервале температур.
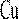

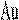

















 При упорядочении возрастает электропро-водность, твёрдость, прочность, снижается плас-тичность сплава, изменяются магнитные свойства.
При упорядочении возрастает электропро-водность, твёрдость, прочность, снижается плас-тичность сплава, изменяются магнитные свойства.

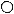







 Упорядоченные твёрдые растворы можно рассматривать, как промежуточные фазы между твёрдыми растворами и химическими соединениями.
Упорядоченные твёрдые растворы можно рассматривать, как промежуточные фазы между твёрдыми растворами и химическими соединениями.
Твёрдые растворы внедрения.
При образовании твёрдого раствора внедрения атомы растворённого компонента располагаются в междоузлиях (порах) кристаллической решётки растворителя. Такие твёрдые растворы образуют металлы с неметаллами.
Основным условием, определяющим возможность растворения путём внедрения, является размерный фактор. Размер межузельного атома должен быть равным или несколько больше размера поры (междоузлия).
Твёрдые растворы внедрения всегда имеют ограниченную растворимость и встречаются преимущественно тогда, когда растворитель имеет решётки ГПУ или ГЦК.
Примером твёрдых растворов внедрения, имеющих промышленное значение, являются твердые растворы углерода в Fe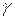 . Искажение решётки, которое появляется при образовании твёрдых растворов внедрения, превышают те, которые возникают при образовании твёрдых растворов замещения, в связи с чем более резко изменяются и свойства. По мере увеличения концентрации растворённого элемента в твёрдом растворе заметно возрастает электросопротивление, коэрцитивная сила, твёрдость и прочность, но заметно понижаются пластичность и вязкость.
. Искажение решётки, которое появляется при образовании твёрдых растворов внедрения, превышают те, которые возникают при образовании твёрдых растворов замещения, в связи с чем более резко изменяются и свойства. По мере увеличения концентрации растворённого элемента в твёрдом растворе заметно возрастает электросопротивление, коэрцитивная сила, твёрдость и прочность, но заметно понижаются пластичность и вязкость.
Таким образом, твёрдые растворы – это кристаллы, наиболее близкие по свойствам к растворителю, т. к. сохраняют его кристаллическую решётку и тип связи. Твёрдые растворы на основе металлов отличаются хорошей технологической пластичностью: хорошо деформируются в горячем состоянии, а многие и в холодном. Они составляют основу большинства промышленных конструкционных сплавов и сплавов специального назначения.
Химические соединения.
При переходе в твёрдое состояниеразнородные атомы могут соединяться в определённой пропорции, образуя новые вещества – химические соединения.
Характерные особенности химических соединений следующие:
1. Кристаллическая решётка отличается от решёток компонентов, образующих соединение. Атомы в решётке химического соединения расположены упорядоченно, т. е. атомы каждого компонента расположены закономерно и по определённым узлам решётки. Большинство хим. соединений имеют сложную кристаллическую решетку.
2. В соединении всегда сохраняется простое кратное соотношение компонентов. Это позволяет выразить их состав простой формулой AnBm, где А и В - компоненты сплава, а n и m – простые числа.
3. Свойства хим. соединений резко отличаются от свойств образующих его компонентов.
4. Температура плавления постоянная.
5. Образование хим. соединения сопровождается значительным тепловым эффектом.
В отличие от твёрдых растворов хим. соединение обычно образуется между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решёток.
Соединения одних металлов с другими носят название интерметаллических соединений или интерметаллидов.
Соединения металлов с неметаллами, которые могут обладать металлической связью, нередко также наз. металлическими соединениями.
Металлические свойства у хим. соединений выражены слабее, чем у чистых металлов и твёрдых растворов. Хим. соединения имеют повышенную твёрдость и пониженную пластичность.
Характерное отличие хим. соединения металлов от твёрдого раствора заключается в том, что твёрдый раствор имеет кристаллическую решётку металла растворителя, а хим. соединение – свою особую кристаллическую решётку.
§ 3. Механические смеси.
Механическая смесь двух чистых металлов А и В получается в том случае, когда в процессе кристаллизации сплава из жидкого состояния разнородные атомы не входят в общую кристаллическую решётку, а образуют самостоятельные кристаллы. Кристаллы каждого из металлов, находящихся в этом сплаве, имеют тоже строение и свойства, которыми они обладают в куске чистого металла. Этот случай соответствует полной нерастворимости компонентов в твёрдом состоянии. Кристаллы элементов, входящих в сплав, образуют простую механическую смесь.
Эта смесь может состоять из кристаллов различной формы и размеров т. е. различной дисперсности.
Механическая смесь – это смесь двух фаз.
§ 4. Правило фаз.
Закономерности всех изменений системы в зависимости от внутренних и внешних условий подчиняются правилу фаз Гиббса.
Правило фаз устанавливает возможное число фаз и условия, при которых они могут существовать в данной системе.
Правило фаз применимо только для равновесных условий.
Правило фаз устанавливает зависимость между числом степеней свободы, числом компонентов и числом фаз:
С=К+ Р – Ф,
Где С – число степеней свободы системы (вариантность)
К – число компонентов, образующих систему
Р – число внешних переменных факторов (температура, давление)
Ф – число фаз, находящихся в равновесии.
Под числом степеней свободы (вариантностью системы) понимают возможность изменения температуры, давления и концентрации без изменения числа фаз, находящихся в равновесии.
Применяя правило фаз к металлам, во многих случаях можно принять изменяющимся только один фактор – температуру, т. к. давление мало влияет на фазовое равновесие сплавов (за исключением очень высокого), тогда правило фаз примет вид:
С=К+1 – Ф
Т. к. число степеней свободы не может быть меньше 0 и не может быть дробным числом, то число фаз в системе не может быть больше числа компонентов плюс 1. Значит, в двойном сплаве не может быть больше 3 фаз, а в тройном – 4.
Если в равновесии находится максимальное число фаз (3), то число степеней свободы системы равно 0 (С=0). Такое равновесие наз. нонвариантным (безвариантным). При таком равновесии сплав из данного числа фаз может существовать только при определённых условиях: при постоянной температуре и определённом составе всех находящихся в равновесии фаз. Это означает, что превращение начинается и заканчивается при одной постоянной температуре.
При уменьшении числа фаз система может быть моновариантной (С=1) (одновариантной) или бивариантной (С=2) (двухвариантной).
§ 5. Диаграммы состояния двойных сплавов.
Диаграммы состояния в удобной графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации.
Диаграммы состояния строят для условий равновесия или близких к ним.
Равновесное состояние соответствует минимальному значению свободной энергии. Это состояние может быть достигнуто только при очень малых скоростях охлаждения или длительном нагреве. В реальных условиях сплавы находятся в метастабильном состоянии. Изучение диаграмм фазового равновесия позволяет установить природу метастабильного состояния и условия его использования.
Существуют следующие типы диаграмм состояния:
I тип диаграмма состояния сплавов с неограниченной растворимостью компонентов в жидком состоянии и отсутствия растворимости в твёрдом состоянии;
II тип диаграмма с неограниченной растворимостью компонентов в жидком и твёрдом состоянии;
III тип диаграмма с неограниченной растворимостью компонентов в жидком состоянии и ограниченной растворимостью их в твёрдом состоянии;
IV тип диаграммы с неограниченной растворимостью компонентов в жидком состоянии и образованием химических соединений в твёрдом состоянии;
V тип диаграмма с неограниченной растворимостью компонентов в жидком состоянии и полиморфным превращением в твёрдом;
VI тип диаграмма с ограниченной растворимостью компонентов в жидком состоянии и нерастворимостью в твёрдом состоянии.
§ 6. Методика построения диаграмм состояния.
Диаграмма I типа.
Диаграмма состояния сплава представляет собой график, по оси ординат которого откладывают температуру, а по оси абсцисс – концентрацию компонентов.
Крайняя левая точка на диаграмме по оси абсцисс соответствует 100% концентрации металла А и 0% металла В.
Крайняя правая точка на оси абсцисс соответствует 100% концентрации металла В и 0% А.
Каждая промежуточная точка определяет конкретный сплав вполне определённого хим. состава.
Обычно на горизонтальной оси показывают изменение содержания одного компонента в сплаве. Сумма же обоих компонентов равна 100%.
Каждая вертикаль, проведенная через точку на горизонтальной оси, соответствует изменению температуры определенного сплава (линия сплава). Каждая точка на диаграмме определяет состояние сплава заданного хим. состава при данной температуре.
Для построения диаграмм используют метод термического анализа. С его помощью определяют критические точки сплавов и строят кривые охлаждения.
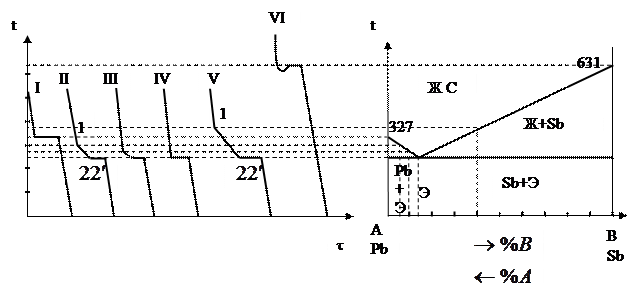 При построении диаграммы берут серию сплавов металлов А и В различного хим. состава. Кривые охлаждения для этих сплавов строят в координатах температура – время. Охлаждение при этом ведётся очень медленно, чтобы процесс кристаллизации пр
При построении диаграммы берут серию сплавов металлов А и В различного хим. состава. Кривые охлаждения для этих сплавов строят в координатах температура – время. Охлаждение при этом ведётся очень медленно, чтобы процесс кристаллизации пр
 2014-02-09
2014-02-09 935
935






