ХАРАКТЕРИСТИКИ.
Оптические ПРИБОРЫ И ИХ ОСНОВНЫЕ
Свечение тел и поглощение ими электромагнитного излучения тесно связано с явлениями, происходящими в атомах и молекулах. По этой причине изучение спектров излучения и поглощения является важным средством познания химического состава, структуры и свойств вещества.
По внешнему виду выделяют три основных типа спектров: линейчатые, полосатые и сплошные. По способу получения различают спектры испускания (эмиссионные спектры) и спектры поглощения (абсорбционные спектры).
Линейчатые спектры испускания состоят из отдельных цветных узких участков, разделенных темными промежутками. Каждому такому участку (линии) соответствует одна определённая длина волны. Они появляются в результате электронных переходов внутри не взаимодействующих друг с другом атомов и ионов различных элементов. Линейчатые спектры дают разрежённые газы или пары в атомарном состоянии. Изучение линейчатых спектров показало, что каждый химический элемент имеет свой характерный линейчатый спектр, отличающийся от спектров других элементов числом линий, их цветом и взаимным расположением.
Полосатые спектры представляют собой совокупность более или менее узких цветных участков (полос), разделенных темными промежутками. Применяя спектральные приборы с высокой разрешающей способностью, можно наблюдать, что полосы состоят из ряда отдельных тесно расположенных линий. Полосатые спектры характерны для отдельных молекул и становятся всё более сложными с увеличением числа атомов в них. Взаимодействие атомов изменяет структуру энергетических уровней. Кроме электронных, у молекул появляются дополнительные энергетические подуровни, связанные с колебательным движением ядер атомов около положения равновесия и вращательным движением молекул. Переходы электронов на эти подуровни и обуславливают структуру полос. Полосатые спектры дают разрежённые газы или пары в молекулярном состоянии.
Раскаленные твердые и жидкие тела, а так же газы под высоким давлением дают сплошной спектр, в котором цвета постепенно переходят один в другой. Сплошные спектры – это результат взаимодействия между собой молекул и ионов. Примером сплошного спектра является спектр белого света.
Спектры поглощения получают, пропуская белый свет через исследуемое вещество (газ, пар, раствор). При этом определённые длины волн будут поглощаться средой более интенсивно, чем другие. В результате на фоне сплошного спектра появляются темные линии (или полосы), характерные для данного вещества. Опыты показывают, что линии поглощения всегда точно соответствуют линиям (или полосам) спектра испускания исследуемой среды. Это происходит в соответствии с законом Кирхгофа: вещество поглощает только те длины волн, которые само может испускать. Этим законом объясняется возникновение темных линий (линий Фраунгофера), наблюдаемых в спектре солнечного излучения. Они всегда занимают одно и тоже положение и в основном представляют собой линии поглощения паров и газов, образующих атмосферу Солнца.
Спектры являются источником самой разнообразной информации о веществе. Методами качественного и количественного (по интенсивности линий) анализа определяют химический состав вещества, строение атомов и молекул, характер межмолекулярного взаимодействия, структуру энергетических уровней, подвижности отдельных частей больших молекул и т.д.
Метод определения химического состава вещества называется качественным спектральным анализом. Точное расположение линий в спектре излучения каждого элемента приводится в специальных таблицах спектральных линий. Для определения содержания элементов с низкой энергией возбуждения (2 ÷ 4эВ) используют фотометрию пламени (рис.1).
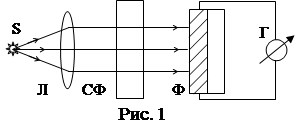 Свет от пламени, в которое введена проба, пропускают через светофильтр СФ, имеющий узкую полосу пропускания Δλ в спектральной области, соответствующей искомому элементу. Далее свет направляют на фотоэлемент, соединенный с чувствительным гальванометром. Имея набор сменных светофильтров, можно изучить различные участки спектра и установить, присутствует ли в пробе тот или иной элемент. Этим способом с большой точностью определятся наличие в пробе щелочных и щелочноземельных элементов, марганца, хрома и др. Фотометрия пламени применяется для анализа природных вод, биологических жидкостей, химических удобрений, медицинских препаратов.
Свет от пламени, в которое введена проба, пропускают через светофильтр СФ, имеющий узкую полосу пропускания Δλ в спектральной области, соответствующей искомому элементу. Далее свет направляют на фотоэлемент, соединенный с чувствительным гальванометром. Имея набор сменных светофильтров, можно изучить различные участки спектра и установить, присутствует ли в пробе тот или иной элемент. Этим способом с большой точностью определятся наличие в пробе щелочных и щелочноземельных элементов, марганца, хрома и др. Фотометрия пламени применяется для анализа природных вод, биологических жидкостей, химических удобрений, медицинских препаратов.
Методы количественного спектрального анализа по интенсивности свечения линий позволяют определять присутствие даже очень малого количества химического элемента в пробе (10-6 – 10-10 г).
 2014-02-09
2014-02-09 1431
1431