V. Текст лекции
IV. Учебно-материальное обеспечение
III. Литература
II. Расчет учебного времени
I. Цели и задачи занятия
1. Изучить физико-химическую природу процессов горения.
2. Изучить классификацию процессов горения и взрыва.
3. Изучить необходимые условия возникновения горения.
Воспитательные:
1. Воспитывать у обучающихся стремление к повышению уровня профессиональных знаний.
Развивающие:
2. Развитие ассоциативного мышления, умения анализировать информацию и на ее основе делать выводы.
| Содержание и порядок проведения занятия | Время, мин |
| ВВОДНАЯ ЧАСТЬ ОСНОВНАЯ ЧАСТЬ Учебные вопросы 1. Общие сведения о горении и взрыве. 2. Механизм химического взаимодействия при горении. Энергия активации. ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ |
основная
1. Корольченко А.Я. Процессы горения и взрыва. – М.: Пожнаука, 2007. – 266 с., ил.
дополнительная
1. Расчетно-аналитические зависимости для решения задач по курсу «Теория горения и взрыва»: справочный материал / сост. Д.В. Батов, Т.А. Мочалова, А.В. Петров. – Иваново: ООНИ ИвИ ГПС МЧС России, 2008. – 35 с.
2. Марков В.Ф., Маскаева Л.Н., Миронов М.П., Пазникова С.Н. Физико-химические основы развития и тушения пожаров: Учебное пособие для курсантов, студентов и слушателей образовательных учреждений МЧС России / Под ред. В.Ф.Маркова. Екатеринбург: УрО РАН. 2009. 274 с.
1. Технические средства обучения: мультимедийный проектор, ноутбук, экран.
Процесс горения занимает важное место в большинстве областей жизнедеятельности людей. Овладев процессами горения и превратив их в один из мощных источников развития всех существующих цивилизаций, человечество столкнулось с негативной стороной собственных достижений, когда процессы горения возникали и развивались вопреки общественным потребностям. Они оказывались неуправляемыми и приносили людям огромные потери и несчастья. Такие процессы горения назвали пожарами. Поскольку всякий пожар связан с возникновением и развитием процесса горения, а его ликвидация означает целенаправленное прекращение этого процесса, то научные основы процессов горения составляют фундамент научных основ процессов тушения пожаров.
Горение является сложным физико-химическим процессом, состоящим из химических реакций окислительно-восстановительного типа. Оно характеризуется самоподдерживанием и саморазвитием и происходит в условиях прогрессивного самоускорения.
Из курса химии известно, что окислительно-восстановительные реакции, сопровождаются переносом электронов с изменением окислительных чисел атомов. Атомы, молекулы или ионы, присоединяющие электроны, являются окислителями. Во время реакции они восстанавливаются. Атомы, молекулы и ионы, отдающие электроны, являются восстановителями, они окисляются.
С0 + О20 ® С+4О2-2
восстановитель окислитель продукты реакции
Типичными окислителями являются:
1. Слайд. Простые вещества, атомы которых обладают большой электроотрицательностью (элементы VI и VII групп периодической системы). С повышением порядкового номера элемента в периодической системе, восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов: фтор – F, хлор - Cl, бром - Br, иод - I. Наиболее активно присоединяют электроны атомы фтора, являющиеся самым сильным окислителем, не отдающие в реакциях электроны. Вторым по величине электроотрицательности, и, следовательно, по окислительной способности является О2, атомы которого могут отдавать электроны только атомам фтора. Другие неметаллы могут не только принимать, но и отдавать электроны, а, значит, проявлять не только окислительные, но и восстановительные свойства.
При взаимодействии с железом сера является окислителем, а при взаимодействии с кислородом сера проявляет свойства восстановителя.
Fe0 + S0 ® Fe+2S-2 S0 + O20 ® S+4O2-2
2. Сложные анионы, в которых более электроположительный элемент имеет высшую или значительную степень окисления, (Mn+7O4)-, (S+6O4)2-. Растворы кислот более сильные окислители, чем растворы их солей, причём окислительная активность первых тем значительнее, чем выше их концентрация. Так, KNO3 почти не проявляет окислительных свойств, разбавленный раствор HNO3 является слабым окислителем, а концентрированная азотная кислота – один из наиболее энергичных окислителей. Приписывание окислительных свойств молекулам вещества является условным. В действительности ими обладают атомы (ионы). Так, принято говорить, что сильным окислителем является перманганат - КMnO4, хотя речь идёт об ионе (MnO4)-.
Процесс перераспределения электронных структур атомов, ионов и молекул сопровождается выделением или поглощением тепла, световым излучением, т.е. преобразованием химической энергии в другой вид энергии.
Горение – экзотермическая реакция окисления вещества сопровождающаяся, по крайней мере, одним из трёх факторов: пламенем, свечением, выделением дыма (СТ СЭВ 383-87. Пожарная безопасность в строительстве. Термины и определения).
Горение – быстропротекающий, окислительно-восстановительный, экзотермический, самоподдерживающийся процесс, часто сопровождающийся образованием пламени.
Для возникновения горения необходимы образование смеси горючего вещества и окислителя определенной концентрации и наличие теплового фактора (источник зажигания; физико-химический или биологический процесс, протекающий с выделением тепла). Условия возникновения горения иллюстрирует треугольник горения (слайд):





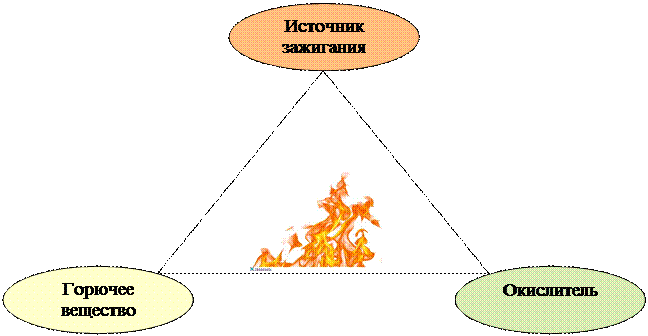
Под воздействием источника зажигания начинается интенсивное протекание реакции окисления между компонентами горючей смеси. Источником зажигания являются импульсы процессов, связанных с переходом в теплоту механической, химической, электрической и лучистой энергий. При этом нагрев горючего вещества осуществляется тремя способами:
- теплопроводностью, при непосредственном соприкосновении материала с источником тепла;
- излучением, при воздействии лучистой энергии от источника нагрева;
- конвекцией, при передаче тепла материалу посредством воздуха или иного газа, находящегося в движении.
Классификация видов и режимов горения
1. В зависимости от агрегатного состояния компонентов горючей смеси различают гомогенное и гетерогенное горение.
Гомогенное горение – процесс взаимодействия горючего и окислителя, находящихся в зоне химической реакции в одинаковом агрегатном состоянии. Примеры: горение горючих газов и паров жидкостей, газообразных продуктов термического распада большинства твёрдых горючих веществ, а в ряде случаев пылевого аэрозоля в среде газообразного окислителя. При этом горючее и окислитель в зоне химической реакции перемешаны и не имеют поверхности раздела.
Гетерогенное горение – процесс взаимодействия горючего и окислителя, находящихся в различных агрегатных состояниях, горение происходит на поверхности раздела фаз. Особенностью гетерогенного горения является отсутствие пламени. Беспламенное горение называют тлением. Примеры: горение антрацита, кокса, древесного угля, нелетучих металлов. При гетерогенном горении кислород (или другой газообразный окислитель) диффундирует сквозь продукты сгорания к поверхности горючего вещества, а затем вступает с ним в химическую реакцию.
2. В зависимости от условий смесеобразования горючих компонентов различают два режима горения: кинетический и диффузионный.
Кинетическое горение – процесс горения гомогенной однородной (предварительно перемешанной) горючей смеси. Скорость кинетического горения определяется скоростью химической реакции, которая, в свою очередь, находится в степенной зависимости от температуры.
В большинстве случаев на реальных пожарах горючее и окислитель предварительно не перемешаны. В этом случае окислитель (кислород воздуха) поступает в пламя из окружающей среды преимущественно за счёт процессов диффузии.
Диффузионное горение – процесс горения неоднородной (предварительно не перемешанной) горючей смеси, в котором существенную роль играют процессы диффузии окислителя к фронту пламени. Скорость диффузионного горения лимитируется скоростью диффузии окислителя к зоне горения.
В условиях пожара газы, жидкости и твёрдые вещества горят диффузионным пламенем.
3. По газодинамическим параметрам различают ламинарное и турбулентное горение (пламя).
Ламинарное горение – процесс, при котором массообмен и перенос тепла происходят путем молекулярной диффузии и возникающих конвективных потоков окислителя и горючего вещества к зоне химической реакции. При этом наблюдается спокойное, безвихревое пламя устойчивой геометрической формы. Например, пламя свечи, горелки бытовой газовой плиты.
Турбулентное горение – процесс, при котором массообмен и перенос осуществляются не только за счет молекулярной, но и турбулентной диффузии, в результате макроскопического вихревого движения газовых слоев горючей смеси. Например, горение газового фонтана, лесные пожары.
4. В зависимости от механизма распространения зоны горения по горючей смеси различают два характерных режима горения:
- дефлаграционноегорение – горение, при котором передача тепловой энергии к свежей горючей смеси осуществляется за счет излучения и теплопроводности (скорость движения тепловой волны по горючей смеси от 0,5 до 50 м/с);
- детонационное горение – горение, при котором передача тепловой энергии к свежей горючей смеси осуществляется за счет быстрого сжатия, достаточно интенсивного, чтобы довести реагирующую среду до состояния адиабатического воспламенения (без теплообмена с окружающей средой). Скорость движения тепловой волны по горючей смеси более 50 м/с (до 2000 м/с).
Дефлаграционное горение наблюдается при воспламенении горючих веществ находящихся в жидком и твёрдом агрегатном состоянии. Детонационное горение в виде взрыва наблюдается в подготовленных равномерно перемешанных газовых смесях.
5. В зависимости от объёма окислителя, давления и температуры, горение вещества может быть полным и неполным.
При полном сгорании веществ, образуются продукты, не способные к дальнейшему взаимодействию (СО2, Н2О, НСl). При неполном сгорании образуются продукты, способные к дальнейшему горению (СО, НСN, NН3).
В условиях пожара при горении органических веществ на воздухе чаще всего полного сгорания не происходит. Признаком неполного сгорания является наличие дыма, содержащего несгоревшие частицы углерода.
Горение большинства горючих веществ сопровождается появлением пламени.
Пламя – это газовый объём, в котором непосредственно происходит реакция горения. Пламя выделяет лучистую теплоту, а также конвективный поток теплоты и газов. Наиболее высокотемпературная поверхность пламени, где протекают окислительно-восстановительные процессы, называется реакционной зоной или фронтом пламени.
Накаленные пары и газы сами по себе светят мало и поэтому горение, например, водорода, этилового спирта, сопровождается бледным пламенем. В ярком пламени содержатся какие-либо твердые частицы или, по крайней мере, очень плотные тяжелые пары. В пламени горящей свечи, дерева, парафина находятся частицы продуктов осмоления и угля, получающиеся в результате пиролиза вещества при горении, поэтому данные пламена очень яркие. Бледное, пламя можно сделать светящимся, внося в него мелкие частицы твердых тел (самую тонкую платиновую проволоку, тонкий порошок песка, сетку, покрытую окислами, например, церия).
Практически без пламени горят графит, кокс, древесный уголь и ряд других веществ потому, что они при горении не выделяют горючих газообразных продуктов. Наблюдаемое при горении этих веществ бледное синее пламя есть результат догорания окиси углерода (СО). Вот почему нельзя закрывать трубу печи до тех пор, пока не прекратится синее бледное пламя, хорошо заметное в темноте, иначе помещение наполняется окисью углерода, газом весьма опасным для жизни животных и людей.
Пары и газы, выделяющиеся при горении горючих веществ, как правило, не содержат свободного кислорода и для горения им необходим кислород воздуха, который проникает к месту горения путем диффузии, поэтому пламя имеет определенное строение. На слайде приводится примерная схема диффузионного пламени, на примере пламени свечи:

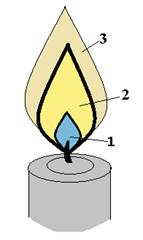
Рис. 1.1. Схема диффузионного пламени (на примере пламени свечи)
Внутренняя зона (1) заполнена парами и продуктами разложения, выделяющимися из горючего вещества в результате его нагревания. Количество диффундирующего из окружающего воздуха кислорода в этой зоне мало и температура в этой зоне сравнительно невысока. На фотографии хорошо видно что первая зона имеет характерный окрас, усиливающийся к краям зоны, что связано с тем что в этой зоне происходит неполное горение с образованием СO являющимся источником синеватого окраса. По мере приближения к краям зоны количество диффундирующего кислорода увеличивается, и горение идет более интенсивно, что хорошо заметно по усилению окраса. В зоне (2), куда частично, проникает кислород воздуха, происходит окисление паров и продуктов разложения, но вследствие недостаточности кислорода именно в этой зоне происходит осмоление и образование мелких частиц угля и поэтому эта зона ярко светится (напомним, что свечение пламени обусловлено наличием в пламени взвешенных частиц твердой фазы). Температура в этой зоне значительно выше, чем в зоне (1). В зоне (3) происходит догорание продуктов, образовавшихся уже в зоне (2), и частично тех паров и продуктов разложения, которые не успели прореагировать в зоне (2). Зона (3) содержит самое большое количество диффундировавшего кислорода т.к. она является самой внешней и имеет наибольшую поверхность. При достатке кислорода происходит полное окисление паров до газообразных продуктов, поэтому именно в этой зоне выделяется наибольшее количество тепла. Температура в этой зоне еще выше, чем в зоне (2), но яркости пламени уже нет, т.к. в зоне почти отсутствуют частицы недогоревшей твердой фазы.
Зона горения в диффузионном пламени представляет собой очень тонкий слой, в котором протекает реакция горения. Его толщина порядка 0,1 - 1,0 мм.
На рис. 1.2. показана схема распределения концентраций газов и паров в ламинарном диффузионном пламени и окружающей его среде.
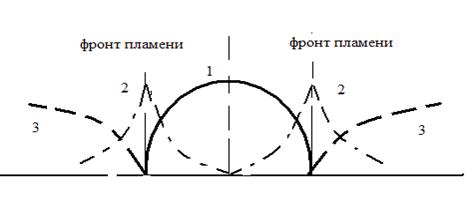
Рис. 1.2. Распределение концентраций газов и паров в ламинарном диффузионном пламени:
1 – пары горючего вещества, 2 – продукты горения, 3 – кислород воздуха.
Эта схема отражает процессы диффузии, происходящие в пламени. Образующиеся в зоне горения продукты сгорания диффундируют как в воздух, так и в горючие пары и газы.
Характер свечения пламени зависит от состава горючего вещества (главным образом от процентного соотношения углерода и кислорода, таблица 1.1.). При термическом разложении веществ с массовой долей углерода менее 50 % и содержащих в своём составе кислород (более 30 %) несгоревших частиц углерода образуется очень мало, и в момент образования они успевают окислиться до СО или СО2. Такие вещества имеют бесцветное пламя. При горении веществ, содержащих более 75 % углерода (бензол, керосин), в зоне горения образуется настолько много частиц углерода, что поступающего путём диффузии в зону горения воздуха не хватает для его полного окисления. Не окислившийся в пламени углерод выделяется в виде копоти, и пламя при горении таких веществ будет ярким коптящим.
Таблица 1.1.
Характер свечения пламени в зависимости от состава горючего вещества
| Характер свечения пламени | Содержание кислорода в горючем веществе, % | Содержание углерода в горючем веществе, % |
| Пламя бесцветное | Более 30 | До 50 |
| Пламя яркое, не коптящее | Отсутствует или менее 30 | Не более 75 |
| Пламя яркое, коптящее | Отсутствует или менее 25 | Более 75 |
*Процентное содержание элементов рассчитывают по формуле:
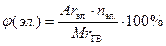 ,
,
где Аrс – атомный вес элемента;
МrГВ – молекулярная масса горючего вещества;
nс – количество атомов данного элемента в формуле горючего вещества.
Быстрое горение смеси сопровождается нагреванием и расширением газов, что вызывает резкое повышение их давления приводящее к взрыву.
Взрыв – быстрое превращение вещества (взрывчатое горение), сопровождающееся выделением энергии и образованием сжатых газов, способных производить работу. (ГОСТ 12.1.010-76. Взрывобезопасность. Общие требования).
Под взрывом понимается явление, связанное с внезапным изменением состояния вещества, сопровождающимся резким звуковым эффектом и быстрым выделением энергии, приводящим к разогреву, движению и сжатию продуктов взрыва (горения) и окружающей среды. Возникновение повышенного давления в области взрыва вызывает образование в окружающей среде ударной волны с сильным, разрушающим действием. При взрыве исходная потенциальная энергия вещества превращается в энергию нагретых сжатых газов, которая в свою очередь при их расширении переходит в энергию движения, сжатия, разогрева среды. Часть энергии остаётся в виде внутренней (тепловой) энергии расширившихся газов.
| ПРЕВРАЩЕНИЕ ЭНЕРГИИ ПРИ ВЗРЫВЕ ß | ||
| ПРЕВРАЩЕНИЕИСХОДНОЙ ПОТЕНЦИАЛЬНОЙ энергии | ||
| ß | ||
| ЭНЕРГИЯ НАГРЕТЫХ СЖАТЫХ ГАЗОВ | ||
| ß | ß | |
| РАСШИРЕНИЕ ГАЗОВ | ВНУТРЕННЯЯ ЭНЕРГИЯ РАСШИРИВшИХСЯ ГАЗОВ | |
| ß | ß | ß |
| ЭНЕРГИЯ ДВИЖЕНИЯ | ЭНЕРГИЯ СЖАТИЯ | ЭНЕРГИЯ РАЗОГРЕВА СРЕДЫ |
| ß | ß | ß |
| В З Р Ы В |
Вывод по вопросу: в основе процесса горения и взрыва лежат реакции окислительно-восстановительного типа, протекающие с высокой скоростью, сопровождающиеся выделением большого количества тепловой и световой энергии.
 2014-02-09
2014-02-09 6827
6827