Физическая природа теплоты и холода одна и тажа, разница в скорости движения молекул.
Когда теплота отводится, движение молекул замедляется и тело охлаждается, и наоборот.
Термодинамическая система - система материальных тел, находящихся как в механическом, так и в тепловом взаимодествии друг с другом и окружающей средой.
Для исследования термодинамических процессов и рассмотрения разделов термодинамики вводят следующие параметры:
Р - давление; V - удельный объем
Т - температура; U - энергия;
I - энтальпия; S - энтропия.
Р - является результатом удара его молекул, о стенки сосудов, в котором находится газ; давление численно равно силе, действующей на единицу поверхности сосуда
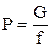 : [P]- [Па]
: [P]- [Па]
T=t+273,15 0: T - [ 0 K, 0 С]
V - отношение объема к единице массы;
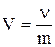 : V - [м3/кг]
: V - [м3/кг]
Масса единицы объема называется плотностью 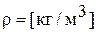
U - энергия тела (газа) есть энергия, которая обладает газ которой он при своем изменении. От некоторого состояния принятого за 0, газ способен отдать в виде теплоты и произведенной им работой.
[U]=[Дж]=[H/м]
Единицей удельной величины внутренней энергии является [ кДж/кг]
1 кДж = 0,239 ккал = 0,00278 квтч
1 ккал = 4,1808 кДж = 0,00116 квтч
i - энтальпия - это есть количество тепла, которой необходимо подвести к 1 кг рабочего тела, чтобы перевести его при р=соnst из начального состояния, характеризуемого температурой 0 0С в данное состояния, характеризуемое температурой t.
[i]=[кДж/кг]=[ккал/кг·· с]
Введение параметра i значительно упрощает расчеты многих термодинамических процессов.
Вид и структура ряда формул позволяет ввести графический метод в исследовании процессов.
S = [кДж / к ] · [ккал / кгс· 0 С]
Всякая затрата энергии равная произведению разности потенциалов (температур, давлений, эектрических напряжений) на приращение некоторой величины.
Удельная теплоемкость <c>
Удельная теплоемкость - это количество теплоты, необходимое для нагревания или охлаждения 1 кг вещества на 10 К.
[c] = [Дж / кг · 0 К]
Удельная теплоемкость у газов показывает изменение энтальпии вещества отнесенное к единице массы, при изменении температуры, на 1 К.
С уменьшением температуры, теплоемкость падает.
ЛЕКЦИЯ № 2
ПЛАН
1. Способы получения низких температур. Плавление. Кипение.
Охлаждение расширением газов. Дросселирование.
Охлаждение вихревым эффектом. Термоэлектрический эффект.
 2014-02-09
2014-02-09 403
403








