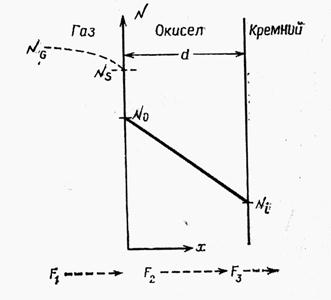
Кинетика процесса окисления Si наиболее точно описывается моделью Дила и Гроува (см. С. Зи Технология СБИС). Она применима для температурного диапазона 700–1300 °С, парциальных давлений O2 (0,2—1,0)∙105 Па и толщины окисных пленок 30–2000 нм в атмосфере, состоящей из кислорода и (или) паров воды. Здесь мы рассмотрим более простую модель. Пусть на поверхности Si уже есть пленка некоторой толщины и примем, что нарастание новых слоев пленки идет на границе раздела пленка – Si (рис. 4.2).
В этом случае окислитель только диффундирует сквозь пленку, не накапливаясь в ней. Иными словами поток атомов окислителя j постоянен по всей ее толще, а градиент концентрации постоянен по толще пленки.
|
| Рис. 4.2. Рост Si02 |
Поэтому первое уравнение для расчета толщины пленки (x) записывается в виде:
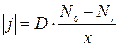 (4.2)
(4.2)
Здесь 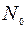 и
и 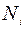 – концентрации окислителя у внешней границы SiO2 и у ее границы раздела с Si соответственно.
– концентрации окислителя у внешней границы SiO2 и у ее границы раздела с Si соответственно.
Второе уравнение отражает наличие химической реакции образования SiO2:
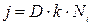 (4.3)
(4.3)
Здесь k – постоянная равновесия химической реакции, которая учитывает свойства взаимодействующих сред, а при окислении монокристаллов и их ориентацию.
Третье уравнение отражает скорость наращивания пленки и  записывается в виде:
записывается в виде:
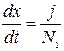 (4.4)
(4.4)
В этом уравнении 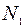 есть концентрация атомов окислителя, необходимых для образования единичного объема пленки.
есть концентрация атомов окислителя, необходимых для образования единичного объема пленки.
Исключив из этих уравнений j и 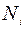 , получим:
, получим:
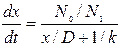 (4.5)
(4.5)
После интегрирования получим:
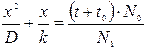 (4.6)
(4.6)
Здесь 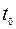 – это постоянная интегрирования, отражающая наличие пленки к моменту начала окисления.
– это постоянная интегрирования, отражающая наличие пленки к моменту начала окисления.
Эта простейшая модель не учитывает некоторых важных моментов.
Полагают, что кислород диффундирует в форме однократно отрицательно заряженных ионов О2-. Процессу перехода кислорода из атмосферы, где он находится в виде молекул О2 в состояние ионов, диффундирующих в оксиде, соответствует химическая реакция
О2 ↔ О2- + e+.
Освобождающиеся при этом электроны или дырки могут захватываться на столь глубокие уровни, что оказываются менее подвижными, чем ионы. При этом в пленке образуется электрическое поле, тормозящее диффузию ионов.
На начальных этапах окисления (см. участок 1, рис. 4.3), когда пленка еще слишком тонкая (мал член с x2), возможно и непосредственное взаимодействие окисляемого материала с окислителем, находящимся в состоянии, характерном для окружающей среды, затем линейный участок (2), плавно переходящий в параболический (3), толщина пленки растет пропорционально времени окисления, скорость роста лимитируется химической реакцией. Далее закон роста может перейти в логарифмическую зависимость, где сказывается действие тормозящего электрического поля. При температурах порядка 400- 500оС электроны и дырки в оксиде кремния становятся достаточно подвижными и не формируют электрического поля, оказывающего заметное влияние на перенос ионов окислителя. Поэтому участок логарифмической зависимости толщины пленки от времени перестает наблюдаться.
Рост толстой пленки лимитируется процессами диффузии, толщина пленки возрастает как t1/2. Все эти процессы сильно зависят от температуры.
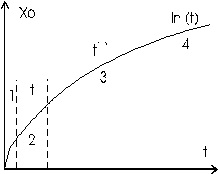
|
| Рис. 4.3. Рост Si02 |
 2014-02-09
2014-02-09 832
832








