Лекция 7. ОСНОВЫ ЭЛЕКТРОХИМИИ
Реакции, протекающие за счет подведенной извне электрической энергии или же, наоборот, служащие источником ее получения, называются ЭЛЕКТРОХИМИЧЕСКИМИ РЕАКЦИЯМИ.
ЭЛЕКТРОХИМИЯ занимается исследованием закономерностей, связанных со взаимным превращением химической и электрической форм энергии.
Для осуществления электрохимической реакции необходима некоторая система – ЭЛЕКТРОХИМИЧЕСКАЯ ЦЕПЬ.
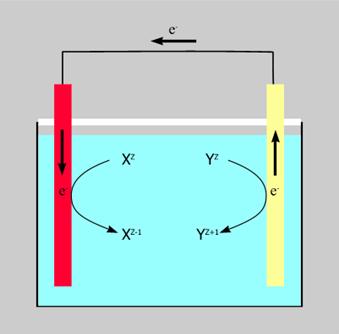
Общая схема электрохимической цепи, в которой протекает реакция
Xz + Yz' = Xz-1 + Yz'+1
Существенные элементы такой системы:
1) два электрода, состоящие из электронопроводящих материалов (металла, графита и т.п.), контактирующих с ионными проводниками (электролитами);
ЭЛЕКТРОД ДОЛЖЕН:
1) ПРОВОДИТЬ ЭЛЕКТРИЧЕСТВО,
2) СОДЕРЖАТЬ АТОМЫ, КОТОРЫЕ ИЗМЕНЯЮТ СВОЮ СТЕПЕНЬ ОКИСЛЕНИЯ.
2) металлический проводник
(проводник I рода), соединяющий электроды и обеспечивающий прохождение электрического тока между ними, он представляет собой внешнюю цепь;
3) раствор электролита, его расплав или твердый электролит (проводники II рода), эта часть системы есть внутренняя цепь.
Электрохимическая цепь работает как химический источник тока (гальванический элемент), если в ней электрический ток возникает в результате самопроизвольно идущей реакции.
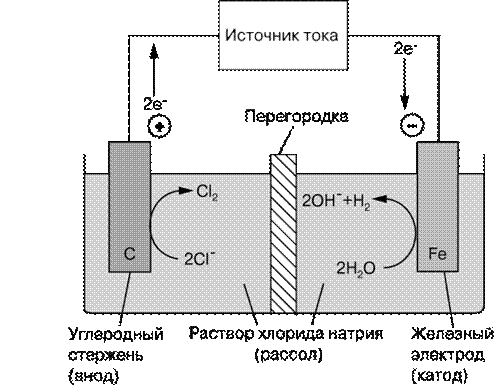
При помощи электрохимической цепи и внешнего источника тока можно осуществить различные химические превращения веществ. Такая цепь работает как электролизер.
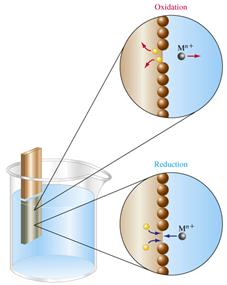
МЕЖДУ МЕТАЛЛОМ И ОКРУЖАЮЩЕЙ СРЕДОЙ (т.е. на границе раздела электроно- и ионопроводящих фаз) ВОЗНИКАЕТ ОПРЕДЕЛЕННАЯ РАЗНОСТЬ ПОТЕНЦИАЛОВ, КОТОРУЮ НАЗЫВАЮТ ЭЛЕКТРОДНЫМ ПОТЕНЦИАЛОМ МЕТАЛЛА.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ может принимать:
1) ПОЛОЖИТЕЛЬНОЕ ЗНАЧЕНИЕ, если металлические ионы получают электроны от электрода, образуют атомы металла, и электрод заряжается положительно.
Me2+(ж) + 2 ē → Me(т)
2) ОТРИЦАТЕЛЬНОЕ ЗНАЧЕНИЕ, если металл электрода окисляется, растворяется, образуются положительно заряженные ионы металла (катионы); излишек электронов остается на поверхности электрода, и электрод заряжается отрицательно.
Me(т) → Me2+(ж) + 2 ē
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ – УСТРОЙСТВО, где в результате окислительно-восстановительной реакции возникает электрический ток.
Элемент Вольта — первый гальванический элемент - был создан в 1799 г. физиком Вольта.
Схема https://ru.wikipedia.org
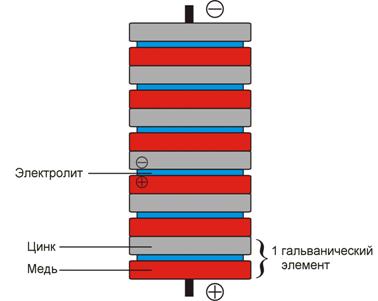
Вольтов столб— применявшееся на заре электротехники (1800) устройство для получения электричества.
Zn ↔ Zn2+ + 2 ē окисление
2 H+ + 2 ē = H2↑ восстановление
В 1800 году итальянский учёный Алессандро Вольта опустил в банку с кислотой две пластинки — цинковую и медную — и соединил их проволокой. После этого цинковая пластина начала растворяться, а на медной стали выделяться пузырьки газа. Вольта предположил и показал, что по проволоке протекает электрический ток.
Для удобства Вольта придал ему форму вертикального цилиндра (столба), состоящего из соединённых между собой колец цинка, меди и сукна, пропитанных кислотой.
Вольтов столб высотою в полметра развивал напряжение, чувствительное для человека.
В 1803 русский физик Василий Петров создал самый мощный в мире вольтов столб, составленный из 4 200 медных и цинковых кругов и развивающий напряжение до 2 500 вольт. С помощью этого прибора ему удалось открыть такое важное явление, как электрическая дуга, применяемая в электросварке; а в Российской армии стал применяться электрический запал пороха и взрывчатки.
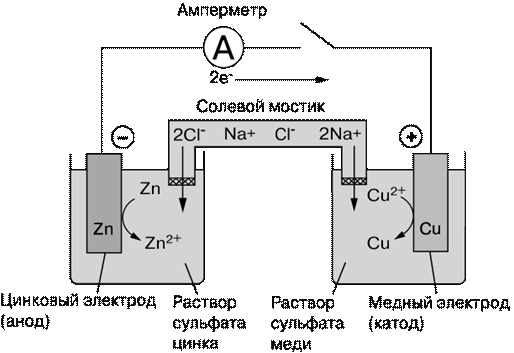
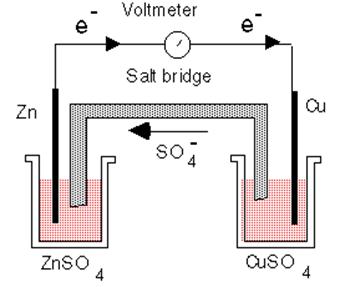
Элемент ДАНИЭЛЯ – ЯКОБИ
или медно-цинковый элемент
|
НА ОТРИЦАТЕЛЬНОМ НА ПОЛОЖИТЕЛЬНОМ ЭЛЕКТРОДЕ, АНОДЕ: ЭЛЕКТРОДЕ, КАТОДЕ:
Мет. цинк окисляется, Катионы меди Cu2+ ионы Zn2+ восстанавливаются;
переходят в раствор: осаждение меди:
Zn ↔ Zn2+ + 2 ē Cu2+ + 2 ē = Cu
(окисление) (восстановление)
Электрод, на котором происходит ОКИСЛЕНИЕ, является анодом,
а ВОССТАНОВЛЕНИЕ – катодом.
Электрохимические ячейки часто представляют схематически, обозначая границу между электродом и электролитом вертикальной чертой (|), а солевой мостик – двумя черточками (||).
СХЕМА ЭЛЕМЕНТА:
(-) Zn│ ZnSO4 ║ CuSO4│ Cu (+)
В элементе протекает суммарная окислительно-восстановительная реакция:
Cu2+(ж) + Zn(т) = Cu (т) + Zn2+(ж)
Разность равновесных потенциалов
двух электродов, из которых составлен гальванический элемент, представляет собой его электродвижущую силу (э.д.с.).
В общем виде, э.д.с. гальванического элемента:
E = Eкатода – Eанода
Э.д.с. гальванического элемента Даниэля:
E = ECu2+/Cu - EZn2+/Zn = ECu - EZn
E° = ECu°- EZn° = 0,34 – (-0,76) = 1,1 В
СТАНДАРТНЫЙ ПОТЕНЦИАЛ (Е°) – это э.д.с. гальванического элемента, составленного из водородного электрода и исследуемого электрода.
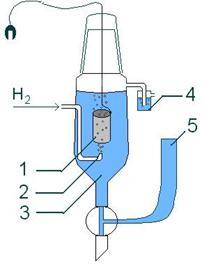
Схема стандартного водородного электрода:
www.wikipedia.org
1. платиновый электрод
2. подводимый газообразный водород
3. раствор кислоты (обычно HCl),
СH+ = 1моль/л
4. водяной затвор,
5. электролитический мост (состоящий из концентрированного
р-ра KCl).
По договоренности, э.д.с. стандартного водородного электрода принимается равной 0 (ЕН+° = 0,00 В)
Потенциалы других электродов, измеренные относительно водородного электрода в стандартном состоянии называют стандартными окислительно-восстановительными потенциалами (E0 или e0, В) или стандартными потенциалами.
Стандартные условия: 25 °C (298,15 K)
Электролит – раствор 1 M HCl (H+, 1 M)
Давление водорода 1 атм
Концентрация ионов Men+ составляет 1 M
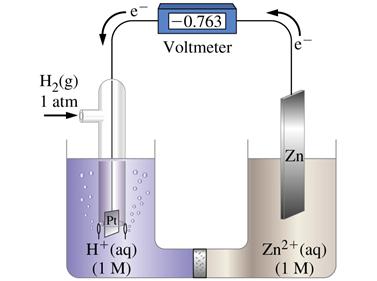
На поверхности платины, Pt:
2 H+(ж) + 2 ē ↔ H2(г)
Zn(тв) ↔ Zn2+(ж) + 2 ē
СХЕМА ЭЛЕМЕНТА:
(-) Zn│1 М Zn2+║ Н+│H2 (1 atm)│Pt(тв) (+)
Если [Zn2+] = 1 моль/дм3, то EZn = EZn°
СТАНДАРТНЫЕ ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
| Вещество | E◦, V | Вещество | E◦, V |
| Li | -3,04 | Ni | -0,25 |
| K | -2,92 | Sn | -0,14 |
| Ca | -2,87 | Pb | -0,13 |
| Na | -2,71 | 2 H+ + 2 ē | 0,00 |
| G | -2,38 | Cu | 0,34 |
| Al | -1,66 | Ag | 0,80 |
| Zn | -0,76 | Au | 1,50 |
| Fe | -0,44 | Ce4+ + 2 ē | 1,61 |
| Cr | -0,41 |
Электродвижущая сила гальванического элемента, в котором реакция протекает самопроизвольно, есть величина положительная и Еk > Еa,
то есть электрод, на котором совершается процесс восстановления, имеет более положительный потенциал, чем электрод, на котором идет процесс окисления.
H:\YKI3030_09\Galvanic_serie.doc
 2014-02-09
2014-02-09 803
803







