Второе начало термодинамики.
Первое начало термодинамики, выражая закон сохранения и превращения энергии, не позволяет точно установить направление протекания термодинамических процессов.
Второе начало было сформулировано выше, но в виде закона возрастания энтропии. Укажем ещё две формулировки второго начала.
Второе начало по Кельвину.
Невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу.
Второе начало по Клаузиусу.
Невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
В середине XIX века возникла теория тепловой смерти Вселенной. Рассматривая Вселенную как замкнутую систему и применяя к ней второе начало, Клаузиус пришёл к выводу, что энтропия Вселенной должна достигнуть своего максимума. Это означает, что со временем все формы движения должны перейти в тепловую. Переход же теплоты от горячих тел к холодным приведёт к тому, что температура во всей Вселенной сравняется, т.е. наступит полное тепловое равновесие, т.е. наступит тепловая смерть Вселенной.
|
|
|
Ошибочность вывода заключалась в том, что бессмысленно применять второе начало к незамкнутым системам, например Вселенной.
Идеальный газ – есть некоторая идеализация, где не учитываются собственные объёмы молекул и взаимодействия молекул друг с другом (притяжение и отталкивание). Этой идеализацией можно пользоваться когда газ достаточно разрежен. В реальном газе надо учитывать собственные объёмы молекул и взаимодействия между молекулами.
Учёт собственных объёмов молекул сводится к учёту сил отталкивания между молекулами, поскольку именно силы вотталкивания препятствуют проникновению одной молекулы в объём, занимаемый другой молекулой.
Минимальное расстояние, на которое две молекулы могут подойти друг к другу – есть их диаметр. Поэтому, для молекулы не доступен объём, равный:

Тогда в расчёте на одну молекулу, недоступен объём, равный учетверённому объёму одной молекулы (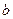 ). Значит,
). Значит,
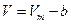
Учёт сил притяжения сводится к тому, что на газ оказывается дополнительное давление:
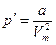
Следовательно:

Тогда уравнение состояния реального газа для одного моля:
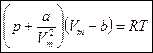 - уравнение Ван-дер-Ваальса
- уравнение Ван-дер-Ваальса
Поправки 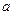 и
и 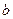 , характеризующие данное вещество, можно определить из уравнения, записав его для 2-ч разных состояний.
, характеризующие данное вещество, можно определить из уравнения, записав его для 2-ч разных состояний.
Уравнение Ван-дер-Ваальса для произвольного количества вещества:
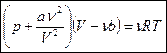

 2014-02-09
2014-02-09 1011
1011








