Все законы в термодинамике основываются на использовании функций состояния, называемых термодинамическими потенциалами. Каждому набору независимых параметров соответствует свой термодинамический потенциал. Изменения потенциалов, происходящие в ходе каких-либо процессов, определяют либо совершаемую системой работу, либо получаемую системой теплоту.
При рассмотрении термодинамических потенциалов мы будем пользоваться соотношением
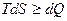 .
.
Внутренняя энергия. С одним из термодинамических потенциалов мы уже хорошо знакомы. Это - внутренняя энергия системы. Выражение первого начала термодинамики для обратимого процесса можно представить в виде
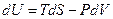 . (9)
. (9)
Как видно отсюда, в качестве естественных переменных для потенциала 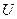 выступают переменные
выступают переменные 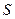 и
и 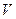 . Тогда
. Тогда
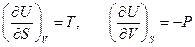 .
.
Свободная энергия. Согласно (9) работа, производимая телом при обратимом изотермическом процессе, может быть представлена в виде:
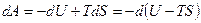 .
.
Функцию состояния
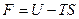 (10)
(10)
называют свободной энергией тела. Возьмём дифференциал от функции (10). Приняв во внимание (9), получим
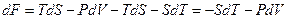 .
.
Таким образом, естественными переменными для свободной энергии являются 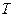 и
и 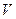 . Тогда
. Тогда
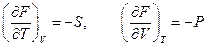 .
.
Энтальпия. Если процесс происходит при постоянном давлении, то количество получаемой телом теплоты можно представить следующим образом
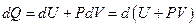
Функцию состояния
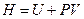 (11)
(11)
называют энтальпией или тепловой функцией. Дифференцируя выражение (11) с учётом (9), получим
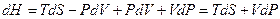 .
.
Отсюда заключаем, что энтальпия есть термодинамический потенциал в переменных 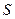 и
и 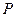 . Его частные произведения равны
. Его частные произведения равны
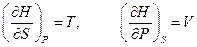 .
.
 2014-02-10
2014-02-10 351
351







