В термодинамике большую роль играют понятия равновесного состояния и обратимого процесса. Равновесным состоянием системы называется такое состояние, при котором параметры системы имеют определённые значения, остающиеся при неизменных внешних условиях постоянными сколько угодно долго. Процесс, состоящий из непрерывной последовательности равновесных состояний, называется равновесным или квазистатическим. Из сказанного следует, что равновесным может быть только бесконечно медленный процесс. При достаточно медленном протекании реальные процессы могут приближаться к равновесному процессу сколько угодно близко. Равновесный процесс может быть проведен в обратном направлении, причём система будет проходит через те же состояния, что и при прямом ходе, но в обратной последовательности. Поэтому равновесные процессы называют также обратимыми процессами. В случае обратимого процесса при возвращении в исходное состояние ни в самой системе, ни в окружающих телах не остаётся никаких изменений. Если такие изменения появляются, то такой процесс называется необратимым процессом. Все реальные процессы необратимы. В механических процессах необратимость вызывается трением.
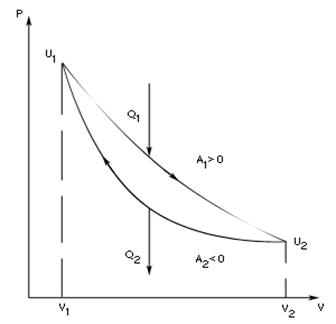 Процесс, при котором система переходит из состояния 1 в состояние 2, а затем возвращается в состояние 1 через другие промежуточные процессы, называется круговым процессом или циклом. Графически цикл изображается замкнутой кривой.
Процесс, при котором система переходит из состояния 1 в состояние 2, а затем возвращается в состояние 1 через другие промежуточные процессы, называется круговым процессом или циклом. Графически цикл изображается замкнутой кривой.
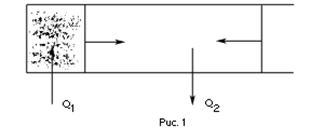 Всякая тепловая машина представляет собой систему, совершающую много кратно некий круговой процесс (цикл). Пусть в ходе цикла рабочее вещество (например, газ) сначала расширяется до объёма
Всякая тепловая машина представляет собой систему, совершающую много кратно некий круговой процесс (цикл). Пусть в ходе цикла рабочее вещество (например, газ) сначала расширяется до объёма 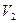 , а затем сжимается до первоначального объёма
, а затем сжимается до первоначального объёма 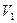 (рис. 1). Чтобы работа за цикл была больше нуля, давление, (а, следовательно, и температура) в процессе расширения должно быть больше, чем при сжатии. Для этого рабочему веществу нужно в ходе расширения сообщать теплоту, а в ходе сжатия отнимать от него теплоту. Совершив цикл, рабочее вещество возвращается в исходное состояние. Поэтому изменение внутренней энергии за цикл равно нулю. Количество теплоты, сообщаемой рабочему телу за цикл, равно
(рис. 1). Чтобы работа за цикл была больше нуля, давление, (а, следовательно, и температура) в процессе расширения должно быть больше, чем при сжатии. Для этого рабочему веществу нужно в ходе расширения сообщать теплоту, а в ходе сжатия отнимать от него теплоту. Совершив цикл, рабочее вещество возвращается в исходное состояние. Поэтому изменение внутренней энергии за цикл равно нулю. Количество теплоты, сообщаемой рабочему телу за цикл, равно
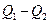 ,
,
где 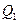 – теплота, получаемая рабочим телом при расширении, а
– теплота, получаемая рабочим телом при расширении, а 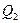 – теплота, отдаваемая при сжатии. Работа
– теплота, отдаваемая при сжатии. Работа 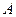 , совершаемая за цикл, равна площади цикла. Таким образом, первое начало термодинамики, написанное для цикла, имеет вид
, совершаемая за цикл, равна площади цикла. Таким образом, первое начало термодинамики, написанное для цикла, имеет вид
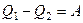 . (1)
. (1)
Как следует из этого выражения, не вся получаемая извне теплота 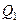 используется для получения полезной работы.
используется для получения полезной работы.
Коэффициентом полезного действия 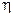 (сокращённо КПД) тепловой машины называется отношение совершаемой за цикл работы
(сокращённо КПД) тепловой машины называется отношение совершаемой за цикл работы 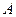 к полученной за цикл теплоте
к полученной за цикл теплоте 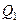
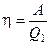 .
.
Приняв во внимание соотношение (1), выражение для КПД можно записать в виде
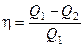 .
.
Второе начало термодинамики:
Невозможно построить периодически действующую тепловую машину, которая бы всю подводимую к ней теплоту превращала в работу, т.е. всегда 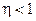 .
.
 2014-02-10
2014-02-10 558
558







