Клетки организма даже в пределах одной ткани имеют различную радиочувствительность. Это зависит от стадии их развития, возраста, функционального состояния. Компоненты самой клетки также обладают различной радиочувствительностью; наибольшая чувствительность свойственна ядру.
Немедленных морфологических изменений в клетках при облучении в дозах до 1000Р не обнаруживается; в зависимости от величины дозы они появляются на 2-3 сутки. В цитоплазме после облучения происходит:
§ изменение вязкости; при малых дозах она снижается, при больших - повышается;
§ вакуолизация цитоплазмы (отчетливо просматривается у клеток крови, красного костного мозга, паренхиматозных органов);
§ повышение проницаемости мембран для электролитов и воды - из клетки выходит калий, а в ней накапливается натрий (у эритроцитов это приводит к гемолизу);
§ повышение коэффициента лучевого преломления, что, по-видимому, связано с денатурацией белков плазмы.
Одновременно могут наблюдаться и другие прижизненные изменения цитоплазмы: различные степени прижизненного окрашивания, изменения восприятия кислых и основных красителей и др.
В облученных клетках наблюдается увеличение размеров ядер. В дальнейшем изменяется форма ядра, появляются гигантские ядра, тройные звезды в митозе, трех- и четырехъядерные и гиперсегментированные клетки, некротические явления - пикноз и реже лизис ядра. Подвижные клетки после облучения обычно принимают округлую форму.
Существует группа лучевых повреждений клетки, которые она легко переносит: повреждение множественных структур клетки, нарушение метаболизма (в том числе ингибирование нуклеинового обмена, окислительного фосфорилирования и др.). Эти преходящие клеточные реакции называю физиологическими или кумулятивными эффектами облучения. Они проявляются в ближайшее после облучения время и вскоре исчезают.
Универсальным примером преходящих лучевых клеток является радиационная блокировка митозов. Еще на заре становления радиобиологии было замечено, что количество делящихся клеток в популяции после облучения резко снижается. Отсюда возникла идея лучевого подавления развития опухолей. В настоящее время доказано, что время задержки митозов строго зависит от дозы облучения и этот эффект проявляется у всех клеток, независимо, выживут они после облучения или погибнут. В опытах на синхронизированных культурах клеток было получено, что задержка деления составляет примерно 1 час на 1Гр, причем с увеличением дозы облучения возрастает не доля реагирующих клеток, а величина реакции (продолжительность задержки деления) каждой облученной клетки. Наиболее выражена задержка деления при облучении клеток в синтетической и постсинтетической фазах клеточного цикла. Из-за различий времени задержки митозов восстановление митотической активности пула происходит волнообразно, т.к. любая делящаяся ткань представляет собой асинхронную клеточную популяцию. Динамика митотической активности клеток после облучения зависит от дозы и вида облучения. Вскоре после первичного падения, митотический индекс резко повышается, а затем снова снижается. Это начальное повышение - не истинное увеличение числа митозов, не возврат к норме, а одновременный митоз сильно- и слабозаторможенных клеток. Так образуется компенсаторная волна деления. Радиационная блокировка митозов является защитной реакцией клеток на облучение. Задержку митозов следует отличать от полного подавления митозов, когда клетка сохраняет жизнеспособность, но утрачивает способность делиться.
Летальные реакции клеток. В радиобиологии под клеточной гибелью понимают утрату клеткой способности к пролиферации, а выжившими называют клетки, которые после облучения сохранили способность к неограниченному делению (клонообразованию).
Типы (формы) клеточной гибели:
1. Интерфазная (интеркинетическая) гибель:
§ до деления (под лучом);
§ без деления.
2. Митотическая (репродуктивная) гибель:
§ после первого деления;
§ в последующих делениях;
§ гибель делящихся клеток популяции.
Чем выше доза облучения, тем раньше гибнут клетки. Одной из форм клеточной гибели является слияние двух клеток и образование гигантской клетки. Такие клетки способны к 2-3 делениям до гибели (они нежизнеспособны).
Основной причиной репродуктивной гибели клеток является повреждение ДНК. Типы лучевых повреждений ДНК:
§ одиночные и двойные разрывы (именно они ответственны за летальный исход облучения);
§ повреждение азотистых оснований нуклеотидов с последующим их удалением из ДНК;
§ внутри- и межмолекулярные сшивки типа ДНК-ДНК, ДНК-белок;
Экспериментальные доказательства определяющей роли ядра в клеточной радиочувствительности представлены в блестящих исследованиях Б.Л. Астаурова, использовавшего для этой цели феномен андрогенеза (мужского партеногенеза) - возможности развития организма из мужской зародышевой клетки без процесса оплодотворения.
Б.Л. Астауровым было продемонстрировано получение потомства тутового шелкопряда, состоящего только из самцов, по всем признакам повторяющих отца, путем предварительного облучения готовой к оплодотворению и кладке яиц самки бабочки при дозе 500 Гр (доза, смертельная для самки и ядерного аппарата еще не отложенных яиц). Однако гибель такой обреченной бабочки происходит не сразу, и она могла копулировать с необлученным самцом и отложить яйца. Отложенные после копуляции яйца подвергали тепловому воздействию для побуждения партеногенетического развития. Из таких яиц выходили гусеницы, маркированные только признаками отца, а после окукливания вылуплялись только самцы, которые повторяли признаки отца. Схема опыта приведена на рис. 3.
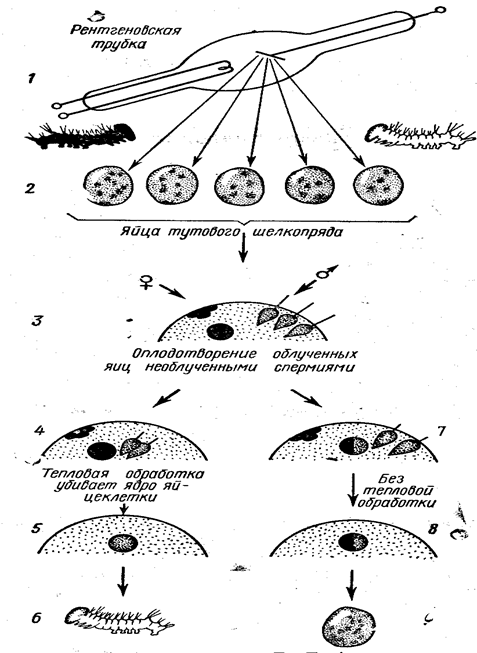 |
Рис. 3. Схема опытов Б.Л. Астаурова (Ярмоненко, 1984)
Причина получения такого андрогенетического потомства состоит в следующем: у тутового шелкопряда в каждую яйцеклетку проникает несколько сперматозоидов, но с женским пронуклеусом сливается ядро лишь одного из них. Так как женский пронуклеус в яйцеклетке был разрушен в результате облучения, то его место заняло ядро одного из проникших в такое облученное ядро сперматозоидов, а ядро сперматозоида приняло на себя роль второго ядерного оплодотворяющего комплекса, что привело к образованию нормального диплоидного ядра, у которого, однако, оба набора хромосом получены от отца. Наиболее важно то, что огромный по сравнению с ядром объем материнской плазмы, также подвергшийся облучению, никак не сказался на жизнеспособности потомства.
Еще одним примером экспериментов, доказывающих несравненно большую радиочувствительность ядра являются опыты И. Орда и К. Даниелли. В опытах на амебах с помощью микрохирургического метода они показали, что пересадка ядер от особей, облученных при дозе 150 Гр, при которой выживает 5% клеток, вызывала примерно такой же летальный эффект (выживало 4% реципиентов). Если же облучению подвергали цитоплазму даже в дозе 250 Гр, после чего в нее трансплантировали необлученное ядро, то эффекта вообще не наблюдалось; все 100% амеб делились и давали жизнеспособное потомство.
Приведенные примеры демонстрируют несравненно большую радиочувствительность ядра по сравнению с цитоплазмой, однако они не отвергают роль последней в радиационном поражении ядерного аппарата. Имеется достаточно большое количество экспериментальных данных об усилении ядерных нарушений и о зависимости их проявления от степени облучения цитоплазмы, что является следствием сложных ядерно-цитоплазматических отношений.
 2014-02-10
2014-02-10 4413
4413
