Наличие «плеча» у кривых доза-эффект свидетельствует о возможности восстановления поврежденных клеток. Облученная клетка каким-то образом ликвидирует повреждения, индуцированные радиационно-химическими реакциями, что составляет сущность пострадиационного восстановления клеток.
Радиационная цитология различает два вида репарации в облученной клетке - восстановление от сублетальных и от потенциально летальных повреждений.
Сублетальными повреждениями называют такие радиационные изменения, которые сами по себе еще не ведут к гибели клетки, но способствуют ее инактивации при последующем облучении. Чем больше в ДНК нелетальных одиночных разрывов, тем больше вероятность того, что при последующем облучении новые одиночные разрывы окажутся вблизи «старых», образовавшихся во второй нити ДНК, что приведет к появлению двойных разрывов - уже летальных повреждений.
Наличие сублетальных повреждений подтверждает эффект фракционирования дозы - уменьшение эффективности облучения при разбиении дозы на фракции, разделенные определенными промежутками времени (рис. 10). Если разделить дозу облучения (например, D50) на две полудозы, разделенные промежутком времени Dt, то можно подобрать такие значения Dt, при которых после суммарного облучения выживаемость клеток будет больше 50%. Это значит, что повреждения, вызванные первой полудозой, уменьшаются ко времени получения второй полудозы.
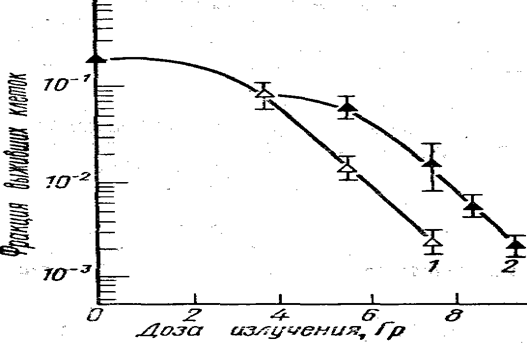 |
Рис. 10. Эффект фракционирования дозы (Ярмоненко, 1984)
При повторном облучении клеток, сохранивших жизнеспособность после первого облучения, форма кривой их выживаемости (2) повторяет соответствующую кривую при однократном облучении (1). На ней вновь возникает плечо-(величина которого при полном восстановлении не отличается от регистрируемого при первом облучении), а наклон (т.е. Do) не изменяется. Эффективность восстановления от сублетальных повреждений оценивают по величине так называемого фактора восстановления - отношения выживаемости клеток при фракционированном облучении к выживаемости при однократном облучении или по величине разности доз двукратного и однократного облучения, требуемых для достижения одинакового эффекта. Величина фактора восстановления зависит от собственной интенсивности восстановления и от скорости перехода клеток в более чувствительные фазы цикла, причем эти процессы противоположно влияют на радиочувствительность клеток в момент второго облучения.
Фактор репарации сильно зависит также от дозы облучения, причем как от первого, так и от последующих. Если доза недостаточно велика и не выходит за пределы Dq, репаративные возможности клетки не могут полностью выявиться и фактор репарации невелик.
Под потенциально летальными повреждениями понимают такие типы поражений, которые вызывают гибель клетки, но в определенных условиях могут быть репарированы. Потенциально летальные повреждения выявляют по изменению выживаемости клеток, под влиянием изменения условий, в которых они находятся в первые часы после облучения.
Влияние условий пострадиационного культивирования клеток на их последующую судьбу показано многими авторами на различных объектах и в разные годы.В 1959 г. В.И. Корогодин доказал реальность существования истинного пострадиационного восстановления, что было зарегистрировано в качестве открытия.
Суть эксперимента заключается в следующем (рис. 11). После γ-облучения дрожжей штамма Мегри-139-В в дозе 1,2 кГр суспензию клеток разводили 1:10000 и делили на две части. Из одной производили посев на питательную среду в чашки Петри сразу после облучения и оценивали выживаемостть, подсчитывая колонии через 96 ч инкубации при температуре 30° С. Другую половину суспензии выдерживали после облучения в течение 48 ч в голодной среде при той же температуре, а затем рассеивали по чашкам. Оказалось, что в первом случае выживало лишь около 0,2% облученных клеток, а во втором - выживаемость составила почти 40%, причем во всех изученных пробах.
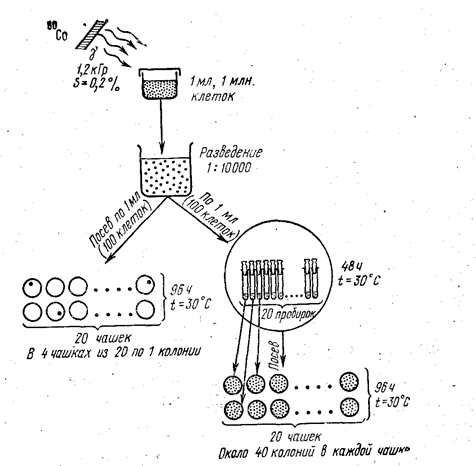 |
Рис. 11. Схема опыта В.И. Корогодина (Ярмоненко,1984)
Результаты этих опытов можно рассматривать как прямое доказательство реальности пострадиационного восстановления дрожжевых клеток, способность к которому «внутренне присуща» облученным клеткам и не зависит от наличия в популяции нелетально пораженных особей.
Способность к восстановлению при фракционированном облучении хорошо совпадает с величиной плеча, поэтому такие параметры кривой выживания, как n и особенно Dq, позволяют предсказать степень поражения различных тканей при повторных облучениях. Отсутствие плеча на кривой выживания при воздействии плотноионизирующими излучениями или при использовании модифицирующих агентов (аноксия) свидетельствует об ингибировании процессов репарации.
На молекулярном уровне наиболее изучена репарация структурных повреждений ДНК, которым приписывают большую роль в клеточной гибели. Интенсивные молекулярно-биологические исследования последних лет выявили и позволили детально охарактеризовать отдельные звенья репарации ДНК, осуществляемой с помощью специальных энзиматических систем.
По времени осуществления различают дорепликативную, пострепликативную и репарации.
Дорепликативная репарация, осуществляемая до этапа удвоения ДНК, может происходить путем воссоединения одиночных или двойных разрывов, а также с помощью эксцизии поврежденных оснований. В воссоединении одиночных разрывов участвуют несколько ферментов. В простейшем случае разрывы могут быть воссоединены лигазой. В других ситуациях требуется полная энзиматическая система репарации, включающая специфические, эндонуклеазы, экзонуклеазы, ДНК-полимеразу, ДНК-лигазу, а также вспомогательные ферменты, обеспечивающие подготовку концов ДНК для заключительного акта репарации - лигазного воссоединения.
Исследованиями, проведенными на бактериальной ДНК, выявлены три типа репарации одиночных разрывов – сверхбыстрая, быстрая и медленная. Сверхбыстрая завершается в течение 1- 2 мин. Как показано А. И. Газиевым, этот процесс обеспечивается только ДНК-лигазой. Быстрая репарация, осуществляемая с помощью ДНК-полимеразы I, воссоединяет 90% разрывов, остающихся после сверхбыстрой репарации. Время воссоединения половины разрывов составляет в зависимости от температуры от 1 до 10 мин. Медленное восстановление завершается за 40-60 мин, воссоединяя около двух разрывов на каждую цепь ДНК, оставшихся после сверхбыстрой и быстрой репараций. Явление репарации двунитевых разрывов в ДНК впервые был обнаружен у Мicrococcus radiodurens, а в последние годы показан и в клетках млекопитающих.
Наряду с разрывами ДНК после облучения возникают множественные повреждения оснований, последние ликвидируются системой эксцизионной репарации, проходящей с помощью репаративного синтеза, представляющего собой многоэтапный процесс типа выщепление - замещение. Вначале повреждение узнается специфической γ-эндонуклеазой, после чего поврежденный участок вблизи измененного основания выщепляется (инцизия), затем происходит экзонуклеотическая деградация поврежденной цепи с захватом смежных неповрежденных нуклеотидов и, наконец, - репаративный синтез в области образовавшегося дефекта при участии ДНК-полимеразы I и полинуклеотидлигазы комплементарного участка неповрежденной цепи ДНК в качестве матрицы (шаблона).
Пострепликативная репарация постулируется на основании того факта, что некоторые клетки млекопитающих выживают при большой дозе излучения, несмотря на пониженную способность к удалению пиримидиновых димеров. Механизм этого вида репарации точно не изучен, предлагаются разные варианты синтеза ДНК на поврежденной матрице. В.И. Корогодиным на дрожжевых клетках было показано, что восстановление на стадии G1 может идти не только до и во время пострадиационного синтеза ДНК, но и после него, а потенциальные повреждения переходят в необратимую форму только во время первого пострадиационного деления ядра. Пострепликативная репарация является не истинным восстановлением, а преодолением повреждений, когда клетка сохраняет жизнеспособность, несмотря на наличие дефектов в ДНК. Сохранение измененной структуры ДНК в поколениях клеток может лежать в основе отдаленных последствий радиационного воздействия.
Репликативная репарация - восстановление ДНК в процессе ее репликации. Этот тип репарации осуществляется удалением повреждений в ходе репликации в зоне пункта роста цепи либо продолжающейся элонгацией в обход повреждения.
7. Системный ответ клетки на лучевое повреждение
Открытие кислородного эффекта, непрямого действия излучений, возможности химической защиты от лучевого поражения привело к отказу от представлений о мгновенности и необратимости первичных повреждений и к признанию модификации лучевого поражения клетки и организма. Многочисленными исследованиями было показано, что ионизация и возбуждение вызывает не только повреждение органических модекул, но и сами эти повреждения способны передавать энергию излучения, т.е. проявлять повреждающую активность по отношению к различным клеточным элементам. Так зародилась идея усиления лучевых повреждений во времени после облучения.
В 1970г. Дертингер и Юнг отмечали, что биологические мембраны, также как и ДНК, могут оказаться структурами, претерпевающими резкие изменения при одном или нескольких событиях поглощения энергии. В связи с тем, что после облучения в клетках удавалось наблюдать лишь деградацию ДНК, а не мембран, биологическим мембранам довольно долго отводилась роль «кандидата на мишень».
Эти представления претерпели существенные изменения после работ, обосновавших роль оксирадкалов в повреждениях ДНК и биологических мембран (Б.Н. Тарусов, Н.В. Лучник, Ю.Б. Кудряшов, Е.Б. Бурлакова). Было показано, что эндогенные повреждения молекулв ДНК в организме являются результатом действия на нее активных форм кислорода (АФК), продуктов перекисного окисления липидов (ППОЛ) и системы оксида азота. Обнаружено, что эндогенные оксидативные повреждения ДНК генотоксичны и при попытке репликайий повреждений вызывают мутации.Основные окисленные основания ДНК, вызывающие цитотоксический, генотоксический и мутагенный эффекты, приведены на рис. 12.
Важную роль в патологии и гибели облученных клеток играет реакция цепного окисления липидов биологических мембран. Эта реакция способствует массовому накоплению в клетке избытка токсических продуктов окисления – ППОЛ в связи с их многократным воспроизведением.
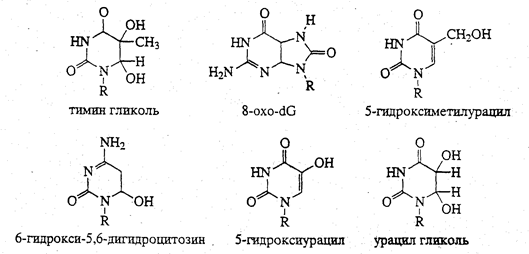
Рис. 12. Окисленные основания ДНК (Кудряшов, 2001г)
Инициирование цепной реакции начинается с того, что в липидный слой биологической мембраны приникают активные радикалы – продукты радиолиза воды. В процессе облучения происходит активация взаимодействия активных радикадов с полиненасыщенными жирными кислотами LH и образование липидных радикалов L· (рис. 13). Липидные радикалы вступают в реакцию с растворенным в среде кислородом, при этом образуются прооксиданты – свободные радикалы липидов: алоксил - LО· или пероксил LО·2. Эти радикалы в свою очередь взаимодействуют с соседними молекулами полиненасыщенных фосфолипидов биологических мембран и образуют гидроперекись липида LOOH и вновь липидный радикал L·. При действии ионизирующих излучений в клетке образуется избыток ППОЛ: гидроперекисей, эпоксидов, альдегидов, кетонов, которые оказывают токсическое действие на клетку.
В таблице 5 приведены некоторые характеристики оксидантов в клетке.
За последние 10-15 лет в молекулярной биологии было установлено, что простое химическое соединение – моноксид азота, образующееся в организме ферментативным путем, выполняет функцию одного из универсальных регуляторов метаболизма. Малые размеры газообразной молекулы NO и отсутствие заряда обеспечивают ее высокую проницаемость через плазматические и внутриклеточные мембраны. В тканях облученных животных активируется NO-синтетаза, в результате чего накапливается избыток оксида азота. Этот процесс инициируется АФК.
Цитотоксические и цитогенетические эффекты обусловлены образованием очень активного окислителя – пероксинитрита, возникающего при реакции оксида азота с супероксидным анион-радикалом:
 2014-02-10
2014-02-10 4828
4828








