Агрегатное состояние выступает как некоторая обобщающая характеристика вещества по отношению к нагрузке на сжатие – сохранение или не сохранение формы и объема массивом вещества.
Агрегатное состояние вещества в основном определяется соотношением средней кинетической энергии молекулы и глубиной потенциальной ямы в межмолекулярном потенциале для парного взаимодействия молекул.
Твердое состояние вещества соответствует средним значениям r 12 практически в самом минимуме потенциальной ямы (примерно d – диаметр частицы), жидкое состояние соответствует средним значениям r 12 того же порядка, но с большей амплитудой отклонений от этого значения, газообразное состояния соответствует расстояниям, намного превышающим d.
Одновременно можно рассмотреть связь агрегатного состояния вещества с кинетической энергии молекул и глубиной потенциальной ямы.
Агрегатное состояние вещества в основном определяется соотношением между средней кинетической энергии молекулы при расстоянии, соответствующем максимальной глубине потенциальной ямы, и самой глубиной потенциальной ямы в межмолекулярном потенциале для парного взаимодействия молекул, обозначим этот параметр Pа
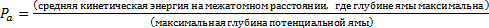
Твердому агрегатному состоянию вещества соответствует 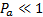 , жидкому состоянию
, жидкому состоянию 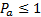 , газообразному
, газообразному 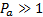 .
.
Фазовое состояние вещества выступает как характеристика внутренней надатомной или надмолекулярной структуры вещества. В пределах одного агрегатного состояния может существовать множество различных фаз. Анизотропия внутренней структуры вещества связана с анизотропной зависимостью межмолекулярных потенциалов:
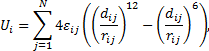
где Ui – потенциальная энергия взаимодействия i -ой частицы со всеми окружающими ее частицами в количестве N.
Однако классическая механика всего не объясняет. Например, почему есть молекула H2, но нет молекулы H3? Это будет объяснено позже, в квантовой механике, в частности, при объяснение будут использован принцип запрета Паули.
Рассмотрим, как выглядят молекулы водорода. Это линейная молекула
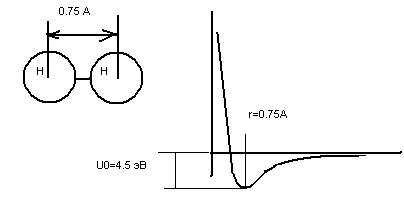
Глубина потенциальной ямы – 4.5 эВ (1эВ –энергия, которую приобретает электрон при прохождении разности потенциалов в 1 вольт. 1 эВ=1.6 *10-12эрг). Рассмотрим еще две двухатомные молекулы – O2 и Cl2. Расстояние между центрами атомов для молекулы кислорода O2 равно 1.2 А, глубина потенциальной ямы 5.1 эВ, для Cl2, соответственно, 2А и 2.5эВ.
Рассмотрим молекулы воды, имеющую отличную от линейной форму.
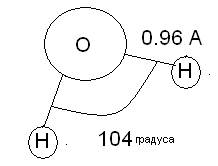
Особенности строения связаны с распределением электронной плотности – она сдвинута к кислороду. Атом кислорода более электроотрицателен, поэтому стягивает к себе отрицательный заряд.
В результате на атоме кислорода локализуется отрицательный заряд, на атоме водорода- положительный заряд. В результате атом кислорода может притягивать к себе водороды других молекул воды. Поэтому каждая молекула воды будет взаимодействовать с другими.
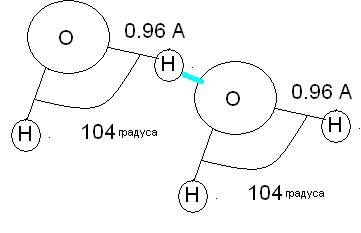
Пример другой молекулы, проявляющей подобную активность – СО2.
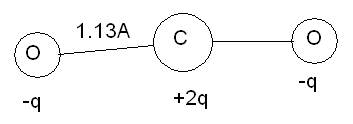
Рассмотрим еще одну единицу измерения, применяемую в молекулярном мире – грамм-молекулу- вес в граммах, равный численно количеству углеродных единиц.
Н2 = 2г
Н2О = 18 г
В 1 моле содержится число Авогадро молекул.
 2014-02-12
2014-02-12 700
700








