Оглавление
Физическая химия
Кафедра физической и аналитической химии
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ГОувпо «Воронежская Государственная
Технологическая Академия»
Краткий конспект лекций
для студентов, обучающихся по направлению
280200 – «Защита окружающей среды»
дневной формы обучения
Воронеж 2010
| Введение……………………………………………………………………………. | ||
| Раздел I. Основы химической термодинамики…………………… | ||
| 1.1 Основные понятия, используемые в химической термодинамике……….. | ||
| 1.2 Первый закон термодинамики и его применение к различным процессам……………………………………………………………………….... | ||
| 1.3 Термохимия | ||
| 1.3.1 Закон Гесса и следствия из него. Расчет тепловых эффектов химических реакций в стандартных условиях…………………….... | ||
| 1.3.2 Понятие о теплоемкости веществ…………………………………… | ||
| 1.3.3 Влияние температуры на тепловой эффектхимической реакции. Уравнение Кирхгофа…………………………………………………. | ||
| 1.4 Второй закон термодинамики. Энтропия…………………………………. | ||
| 1.4.1 Процессы самопроизвольные и несамопроизвольные, обратимые и необратимые…………………………………………................ | ||
| 1.4.2 Формулировки и математическое выражение II закона термодинамики……………………………………………………………….. | ||
| 1.4.3 Изменение энтропии – критерий направления самопроизвольных процессов в изолированных системах | ||
| 1.4.4 Статистическая интерпретация энтропии…………………………….. | ||
| 1.4.5 Расчет изменения энтропии при протекании некоторых процессов……………………………………………………………………… | ||
| 1.4.6 Абсолютные значения энтропии твердых, жидких и газообразных тел………………………………………………………….... | ||
| 1.5 Термодинамические потенциалы и направление самопроизвольных процессов………………………………………………………………………… | ||
| Раздел II. Растворы и гетерогенные равновесия………………….. | ||
| 2.1 Основные понятия и определения…...……………………………………... | ||
| 2.2 Химический потенциал……………………………………………………… | ||
| 2.3 Условие термодинамического равновесия в растворе…………………….. | ||
| 2.4 Условие равновесия в гетерогенной системе……………………………… | ||
| 2.5 Правило фаз Гиббса…………………………………………………………. | ||
| 2.6 Равновесие в однокомпонентной двухфазной системе. Уравнение Клаузиуса-Клапейрона………………………………………….. | ||
| 2.7 Применение правила фаз Гиббса к анализу диаграммы состояния однокомпонентной системы………………………………………………… | ||
| 2.8 Равновесие в гетерогенных системах, состоящихиз двух и более компонентов………………………………………………………………….. | ||
| 2.8.1 Равновесие жидкость-пар……………...………………………………. | ||
| 2.8.2 Коллигативные свойства растворов………………………………....... | ||
| Понижение давления пара над раствором по сравнению с чистым растворителем……………………………………………….. | ||
| Повышение температуры кипения растворов………………………… | ||
| Понижение температуры замерзания растворов……………………... | ||
| Осмос. Осмотическое давление……………………………………….. | ||
| 2.8.3 Равновесие жидкость-жидкость. Распределение вещества между двумя несмешивающимися жидкостями……………………… | ||
| Раздел III. химическое равновесие……………………………………… | ||
| 3.1 Уравнение изотермы химической реакции………………………………... | ||
| 3.2 Влияние внешних условий на протекание химической реакции………… | ||
| Раздел IV. Электрохимия…………………………………………………….. | ||
| 4.1 Равновесие в растворах слабых электролитов…………………………….. | ||
| 4.2 Термодинамика растворов сильных электролитов………………………... | ||
| 4.3 Электрическая проводимость растворов электролитов…………………... | ||
| 4.4 Электродвижущие силы и электродные потенциалы……………………... | ||
| Гальванические элементы, как источники электрического тока…………. | ||
| Механизм возникновения электродных потенциалов и их расчет……….. | ||
| Термодинамика гальванического элемента………………………………... | ||
| Основные типы электродов и расчет их потенциала……………………… | ||
| Раздел V. химическая кинетика и катализ………………………….. | ||
| 5.1 Основной закон химической кинетики. Порядок и молекулярность Реакции…………………………………………………………………………… | ||
| 5.2 Основы формальной кинетики кинетика необратимых реакций………… | ||
| 5.3 Методы определения порядка реакции……………………………………. | ||
| 5.4 Влияние температуры на скорость реакции……………………………….. | ||
| 5.5 Основные понятия катализа………………………………………………… |
Химические реакции связаны с разнообразными физическими явлениями: выделением и поглощением теплоты, изменением объема, испусканием света, электрическими явлениями и т.д. В химических реакциях всегда осуществляется тесная связь физических и химических явлений, изучение этой взаимосвязи – основная задача физической химии.
Физическая химия – это наука о взаимосвязи физических и химических явлений. Физическая химия, опираясь на фундаментальные законы физики и используя результаты физико-химических экспериментов, исследует свойства вещества и химические реакции в совокупности с сопутствующими им физическими явлениями. Она также изучает влияние внешних воздействий на свойства веществ, на химические и фазовые равновесия, скорость протекания химических реакций.
Главное внимание в физической химии уделяется установлению закономерностей протекания химических процессов: возможности их осуществления, направления, механизма, скорости и конечных результатов при различных условиях. Установление таких закономерностей в конечном итоге позволяет прогнозировать ход химического процесса и управлять им, т.е. обеспечивать наиболее полное и быстрое его проведение.
Рассмотрим пример. Синтез аммиака ведется при высоком давлении в присутствии катализатора согласно реакции:
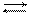 N2 + 3H2 2NH3
N2 + 3H2 2NH3
Если данную реакцию проводить при давлении р = 850 атм, то содержание NH3 в реакционной смеси составляет 30 %. Если же давление повысить до 1700 атм, то выход аммиака повышается до 50 %. Таким образом, при изменении лишь одного физического параметра выход конечного продукта повышается почти в два раза.
Температура, как известно, оказывает существенное влияние на скорость реакции (при повышении температуры на каждые 10 ºС скорость реакции увеличивается в 2 – 4 раза). Однако для некоторых процессов повышение температуры наряду с увеличением скорости может привести к уменьшению выхода продуктов реакции.
Таким образом, изменяя различные физические параметры, можно управлять процессом и подбирать оптимальные условия его проведения.
Возникновение физической химии относится к середине XVIII в. и связано с именем великого русского ученого М.В. Ломоносова. В 1752 г. он написал «Введение в истинную физическую химию», в котором дал близкое к современному определение ее предметной области: «Физическая химия есть наука, объясняющая на основании положений и опытов физики, то, что происходит в сложных телах при химических операциях».
Физическая химия является теоретической основой современных технологий.
Раздел I. Основы химической термодинамики
Термодинамика – Наука о взаимном превращении одних видов энергии в другие.
Различают общую, техническую и химическую термодинамику.
Общая термодинамика рассматривает теоретические основы всех направлений термодинамики.
В технической термодинамике рассматриваются взаимные превращения теплоты и работы применительно, главным образом, к конструированию и эксплуатации тепловых двигателей.
Химическая термодинамика – раздел физической химии, в котором термодинамические методы применяются для анализа химических и физико-химических процессов – химических реакций, фазовых переходов, явлений в растворах и т.п.
 2014-02-12
2014-02-12 527
527







