Влияние концентрации реагирующих веществ.
Если в систему добавлено исходное вещество, то Пр < Кр, следовательно, Δ G < 0 и в системе протекает самопроизвольный процесс, направленный в сторону расходования исходных веществ и образования продуктов реакции. Если в систему добавлен продукт реакции, то Пр > Кр, Δ G > 0 и протекает обратный процесс.
Так как Кр зависит только от температуры, то изменение давления не влияет на ее величину. Однако давление влияет на объем системы, следовательно, в этом случае будет меняться Кх для реакций, протекающих с изменением объема. Константа равновесия Кх связана с Кр уравнением:
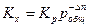 ,
,
Из которого следует, что характер влияния давления на химическое равновесие определяется знаком величины Δ n. Если реакция идет с увеличением объема, то Δ n > 0, и Кх уменьшается, следовательно равновесие смещается в сторону исходных веществ. Для реакций, протекающих с уменьшением объема, Δ n < 0 и равновесие смещается в сторону продуктов реакции.
 2014-02-12
2014-02-12 434
434








