Значение квантовых чисел и максимальное число электронов
| Энергети-ческий уровень | Энергети-ческий подуровень | Возможные значения магнитного квантового числа m | Число орбиталей | Максимальное число электронов | ||
| в под-уровне (2 l + 1) | в уровне n2 | на под-уровне 2(2 l + 1) | на уровне 2 n2 | |||
| K (n = 1) | s (l = 0) | |||||
| L (n = 2) | s (l = 0) p (l = 1) | -1; 0; +1 | ||||
| M (n = 3) | s (l = 0) p (l = 1) d (l = 2) | -1; 0; +1 -2; -1; 0 +1; +2 | ||||
| N (n = 4) | s (l = 0) p (l = 1) d (l = 2) f (l = 3) | -1; 0; +1 -2; -1; 0 +1; +2 -3; -2; -1; 0; +1; +2; +3 |
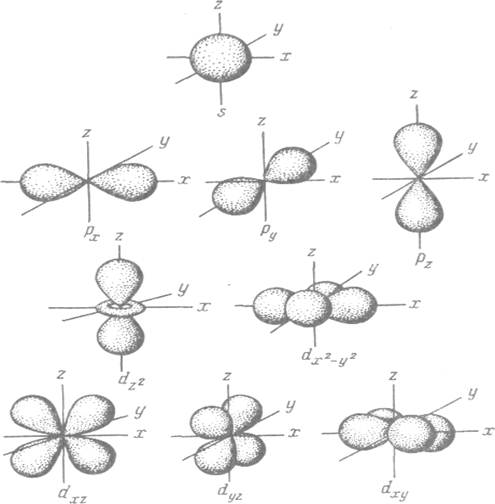
|
Формы s-, p- и d-электронных облаков (орбиталей)
Конфигурация электронной оболочки невозбужденного атома определяется зарядом его ядра. Элементы, в атоме которых последний электрон заполняет s-орбиталь, называются s-элементами, p-, d-, f-орбитали – соответственно, p-, d-, f-элементами.
Металлы – это элементы, у которых от 1 до 3 валентных электронов (находящихся на внешнем энергетическом уровне). Неметаллы – это элементы, у которых от 4 до 8 валентных электронов.
По мере роста заряда ядра атома наблюдается закономерная периодическая повторяемость сходных электронных структур элементов, а, следовательно, и повторяемость их физических и химических свойств, зависящих от строения электронной оболочки атома. Это нашло отражение в современной формулировке Периодического закона Д.И. Менделеева: Свойства простых веществ, а также форма и свойства соединений элементов, находятся в периодической зависимости от заряда ядра атомов элементов.
 2014-02-12
2014-02-12 491
491







