Лекция 7
ГЕТЕРОГЕННЫЙ КАТАЛИЗ
В начальный период развития теории катализа высказывались мнения, что чем больше энергия связи реагирующих веществ с катализатором, тем вероятнее проявление каталитического действия. Это положение неверно и в его несостоятельности легко убедиться даже при качественном рассмотрении изменения вдоль пути реакции. Рассмотрим в качестве примера каталитическую реакцию, протекающую с образованием одного промежуточного соединения реагирующего вещества с катализатором. При увеличении энергии образования промежуточного соединения (переход от S1 к S2 и S3) энергия активации первой стадии каталитического процесса уменьшается и соответственно возрастает ее скорость. Однако одновременно возрастает энергия активации и уменьшается скорость второй стадии процесса. В результате скорость каталитической реакции будет мала как при очень низкой энергии промежуточного взаимодействия, вследствие медленности первой стадии, так и при очень высокой энергии промежуточного взаимодействия, вследствие малой скорости второй стадии. Наибольшую скорость реакции надо ожидать при некоторой средней, оптимальной величине энергии взаимодействия с катализатором. Более строгое рассмотрение вопроса об оптимальной энергии промежуточного взаимодействия реагирующих веществ с катализатором может быть проведено на основе соотношения Бренстеда – Поляни. Рассмотрим каталитическую реакцию:
A1 + A2 + A3 + …. + B1 + B2 +… → P1 + P2 +… + Q1 + Q2 +…,
протекающую в результате промежуточного взаимодействия с катализатором всех или части реагирующих веществ с образованием промежуточного соединения X через стадии:
A1 + A2 + A3 + ….+ К ↔ Х + Р1 + Р2 + …..
Х + В1 + В2 + … ↔ К + Q1 + Q2 + …;
где q - теплота первой стадии;


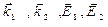 – константы скорости и энергии активации первой и второй стадий при переходе от исходных веществ к продукту.
– константы скорости и энергии активации первой и второй стадий при переходе от исходных веществ к продукту.
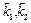 и
и 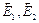 – то же для протекания первой и второй стадий в обратном направлении.
– то же для протекания первой и второй стадий в обратном направлении.
При вариации катализатора может изменяться уровень энергии продукта промежуточного взаимодействия, т.е. значение q. Требуется найти значение q, при котором скорость реакции максимальна при заданных концентрациях реагирующих веществ. Рассмотрим вначале более простой, частный случай, когда скоростями обратных как первой, так и второй стадий, можно пренебречь. На основе соотношения Бренстеда – Поляни
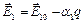
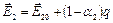
При протекании второй стадии образовавшиеся связи реагирующих веществ с катализатором должны разрываться и энергия активациидолжна возрастать с увеличением q.
В соответствии с этим скорость первой стадии:
12 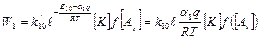 (1)
(1)
и скорость второй стадии
13 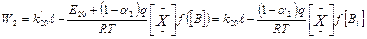 (2)
(2)
где: 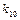 и
и 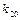 – независящие от q множители в выражении констант скорости 1-ой и 2-ой стадий каталитической реакции. Если концентрация катализатора, а следовательно, и концентрация промежуточного вещества невелика по сравнению с концентрациями реагирующих веществ, то через определенный промежуток времени, при относительно небольшом изменении концентрации реагирующих веществ, будет достигнуто стационарное состояние реакционной системы.
– независящие от q множители в выражении констант скорости 1-ой и 2-ой стадий каталитической реакции. Если концентрация катализатора, а следовательно, и концентрация промежуточного вещества невелика по сравнению с концентрациями реагирующих веществ, то через определенный промежуток времени, при относительно небольшом изменении концентрации реагирующих веществ, будет достигнуто стационарное состояние реакционной системы.
Отвечающая этому состоянию стационарная концентрация промежуточного продукта очень мало меняется по сравнению с изменениями концентраций реагирующих веществ, т.е. со скоростью реакции:

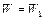 =
=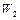
Из соотношений находим стационарную концентрацию промежуточного продукта:


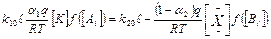
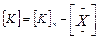
 ;
;
Отсюда скорость реакции 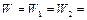
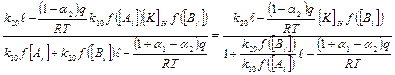 (3);
(3);
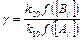 ;
;
если 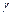 > 1, то при малых q можно пренебречь 1 в знаменателе. В этом случае скорость реакции приближается к скорости первой стадии при
> 1, то при малых q можно пренебречь 1 в знаменателе. В этом случае скорость реакции приближается к скорости первой стадии при  и возрастает с ростом q
и возрастает с ростом q  .
.
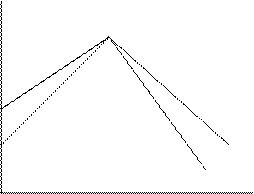
(линия ab).
1 – 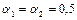
2 – 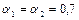
При больших значениях q можно пренебречь вторым членом, скорость
реакции близка к скорости второй стадии при  и снижается с ростом q
и снижается с ростом q 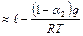 (линия de):
(линия de):




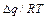
Из условия максимума скорости реакции
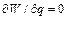
находим: 
 ,
, 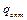 – оптимальная энергия промежуточного взаимодействия, отвечающая максимуму скорости реакции. Разделим на
– оптимальная энергия промежуточного взаимодействия, отвечающая максимуму скорости реакции. Разделим на  :
:
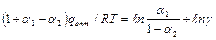 (4)
(4)
 , если
, если 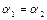 , то
, то 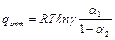 и при
и при 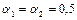
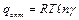 .
.
При 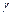 >1 оптимальное значение q
>1 оптимальное значение q 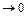 . Найденные уравнения позволяют оценить, насколько уменьшается скорость реакции при отклонении энергии промежуточного взаимодействия от оптимального значения на
. Найденные уравнения позволяют оценить, насколько уменьшается скорость реакции при отклонении энергии промежуточного взаимодействия от оптимального значения на 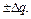
Исходя из уравнения (3), находим:
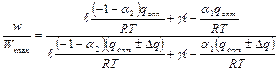 ,
,
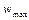 – максимальная скорость реакции при
– максимальная скорость реакции при 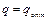 ,
,
 – скорость при энергии взаимодействия при
– скорость при энергии взаимодействия при 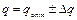 . Согласно уравнению (4):
. Согласно уравнению (4):
 ;
;
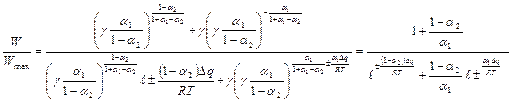 (5)
(5)
На рисунке приведены результаты расчета 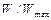 в зависимости от
в зависимости от 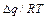 для различных значений
для различных значений 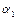 и
и 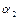 .
.
Найденная зависимость скорости каталитической реакции от энергии промежуточного взаимодействия реагирующих веществ с катализатором справедлива лишь в пределах определенных групп катализаторов и реакций, удовлетворяющих правилу Бренстеду-Поляни. Основным условием для этого является тождественность механизма каталитической реакции и характера связи при промежуточном взаимодействии. Это связано с тем, что скорость стадий каталитической реакции зависит не только от величины энергии промежуточного взаимодействия, но и от типа связи реагирующих веществ с катализатором, ее ковалентности, полярности, участия определенных орбиталей. Это может приводить к отдельным нарушениям рассмотренной зависимости каталитической активности от энергии промежуточного взаимодействия.
Тем не менее, обработка экспериментальных данных указывает на многочисленные случаи линейной корреляции между изменением энергии активации или 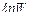 и различными параметрами, включающими энергии связей, определяющие энергии взаимодействия реагирующих веществ с катализатором. В последнее время число сообщений о таких корреляциях увеличиваются.
и различными параметрами, включающими энергии связей, определяющие энергии взаимодействия реагирующих веществ с катализатором. В последнее время число сообщений о таких корреляциях увеличиваются.
Существо дела не в прямой связи т.д. и энергии связей. Т.д. свойства служат лишь средством приближенной характеристики энергии связей. Чем точнее изменение т.д. свойств передает изменение энергии переменных связей активированного комплекса, тем отчетливее проявляется корреляция этих т.д. характеристик с каталитическими свойствами. Несмотря на некоторую произвольность выбора коррелируемых величин это направление безусловно полезно.
 2014-02-12
2014-02-12 640
640







