Подавляющее большинство молекул состоит из атомов разного вида и поэтому содержит полярные ковалентные связи..
Для примера рассмотрим оксид серы SO2. Кислород и сера имеют похожие валентные оболочки (...2s2 2p4 и...3s2 3p4), но внешние электроны серы находятся дальше от ядра и притягиваются к ядру слабее, чем у кислорода (рис. 3-4). Из-за этого поделенные электронные пары в молекуле SO2 смещены вдоль химической связи в сторону атомов кислорода, которые приобретают за счет этого частичный отрицательный заряд (d)..
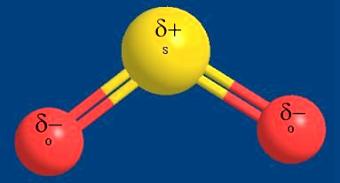
Рис. 3-4. Взаимодействие менее электроотрицательной серы с более электроотрицательным кислородом приводит к соединению с полярными ковалентными связями. Вдоль каждой такой связи электронная плотность смещена в сторону атома кислорода.
Электроотрицательность зависит не только от расстояния между ядром и валентными электронами, но и от того, насколько валентная оболочка близка к завершенной. Фтор является "чемпионом" электроотрицательности по двум причинам. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка расположена близко к ядру. Например, в соединении NaF поделенная электронная пара оттянута к атому фтора так сильно, что такую связь уже лучше назвать ионной Na+ F–
 2014-02-12
2014-02-12 691
691








