Неправильное впечатление может возникнуть в результате чтения схемы, где на одной горизонтальной линии показаны несколько менеджеров, что якобы подразумевает их одинаковый статус. Поэтому иногда довольно сложно с требуемой точностью обозначить реальные отношения, разную значимость должностей и положений.
Руководство (справочник) по организационному построению предприятия. Такие виды документов часто называются отдельными справочниками или инструкциями. Они содержат перечень должностей с их подробным описанием (часто в форме описания производственных обязанностей, взаимоотношений, полномочий, соответствующих принципов и практики).
Распределение обязанностей означает определение масштаба полномочий и меры ответственности по каждой должности, обозначенной на схеме. Здесь же содержится описание выполняемых функций.
В документе «Распределение обязанностей» должны содержаться следующие положения: название должности; отдел, в котором имеется эта должность; уровень положения; описание выполняемых функций; обязанности и права; взаимоотношения с руководством, коллегами и подчиненными; число подчиненных, их особенности; должность непосредственного руководителя; особые полномочия (обязанности); ограничения в полномочиях.
Епишев М.В.
Методические указания
к выполнению лабораторной работы № 6
Определение теплового эффекта химической реакции
по курсу “Физическая химия”
(для студентов металлургических специальностей)
Одобрено
методической комиссией
металлургического факультета
протокол №
от “___”__________2010 г.
________Григорьева М.А.
Утверждено
на заседании
кафедры ТМП
протокол №
от “___”__________2010 г.
________Тарасюк Л.И.
Мариуполь 2010
УДК 544.332:542.06
Методические указания к лабораторной работе № 6 “Определение теплового эффекта химической реакции” по дисциплине “Физическая химия” (для студентов металлургических специальностей) / Сост. М.В. Епишев. – Мариуполь: ПГТУ, 2010. - 13 с.
Включают краткие теоретические сведения из термохимии о тепловых эффектах при химических превращениях. Содержит методические указания к экспериментальной части работы и ее расчетной части, требования к оформлению отчета, вопросы для самоконтроля и список рекомендуемой литературы.
Составители Бондарь В.И., доц.;
М.В. Епишев, ст. преподаватель;
Отв. за выпуск Л.И. Тарасюк, доц.;
Цель работы: Экспериментальное определение теплового эффекта химической реакциявида Me'SO4 + Me'' = Me''SO4 + Ме'+ Q калориметрическим методом.
Теоретическая часть
Тепловым эффектом химической реакции называют теплоту, выделенную или поглощенную в процессе, который протекает необратимо при постоянной объеме или постоянном давлении. Величина теплового эффекта реакции в соответствии с законом Гесса не зависит от ее пути, и определяется видом и состоянием исходных веществ и конечными продуктами. Величину тепловых эффектов химических реакций определяют экспериментальным и расчетными методами. Для некоторых реакций экспериментальное определение тепловых эффектов в нужных условиях вызывает значительные трудности и тогда их определяют опытнымпутем при благоприятных условиях (например, при другой температуре), а затем с помощью расчетов переходят к заданным. С этой целью используют следствия из закона Гесса. Ниже приводятся некоторые из них.
I следствие. Тепловой эффект реакции разложения какого-либо химического соединения равен по абсолютной величине, но противоположен по знаку тепловому эффекту реакции образования этого соединения.
II следствие. Если совершаются две реакции, приводящие из различных исходных состояний к одинаковым конечным, то разница между тепловыми эффектами реакций представляет собой тепловой эффект перехода из одного исходного состояния в другое.
III следствие. Тепловой эффект химической реакции равен сумме теплот образования конечных и исходных продуктов реакции с учетом коэффициентов перед химическими формулами этих продуктов в уравнении химической реакции.
В аналитической форме записи:
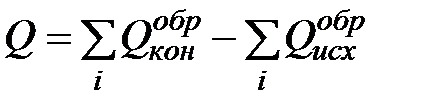 , (1.1)
, (1.1)
где Q – тепловой эффект химической реакции;
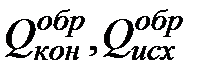 – теплоты образования конечных и исходных продуктов реакции соответственно.
– теплоты образования конечных и исходных продуктов реакции соответственно.
Для определения тепловых эффектов химических реакций испльзуют известные закономерности термохимии. Например, взаимосвязь тепловых эффектов химической реакции при постоянных объеме и давлении:
QV = QP + ΔnRT, (1.2)
где QV и QP – тепловые эффекты одной и той же химической реакции» протекающей при постоянном объеме и постоянном давлении соответственно, Дж;
Δn– разность между числоммолей газообразных продуктов реакции и числом молей газообразных исходных веществ;
R – универсальная газовая постоянная, Дж/(моль·К);
Т – температура, при которой протекает данная реакция, К.
Тепловые эффекты химических реакций зависят от температуры. Такую зависимость выражает уравнение Кирхгофа:
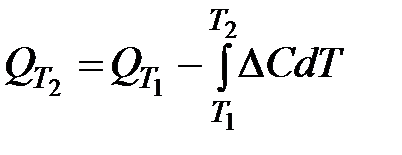 , (1.3)
, (1.3)
где 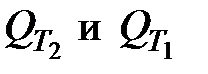 – тепловые эффекты одной и той же реакции при температурах Т2 и Т1, соответственно, Дж;
– тепловые эффекты одной и той же реакции при температурах Т2 и Т1, соответственно, Дж;
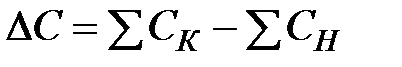 – разность между суммой теплоемкостей продуктов реакции и суммой теплоемкостей исходных веществ, Дж/(моль·К);
– разность между суммой теплоемкостей продуктов реакции и суммой теплоемкостей исходных веществ, Дж/(моль·К);
 2014-10-30
2014-10-30 311
311







