Диаграмма равновесных состояний железо-углерод
Структура сталей и чугунов
Среди диаграмм состояния металлических сплавов самое большое значение имеет диаграмма Fe-C, так как в технике наиболее широкое применение находят железоуглеродистые сплавы, несмотря на растущий спрос на цветные металлы и сплавы, пластмассы, композиционные материалы.
Начало изучения диаграмм железо-углерод было положено Д. И. Черновым в 1868г. открытием критических температур стали и установлением зависимости их от содержания углерода.
Важнейшим вкладом в построение диаграмм Fe-C являются работы Ф. Осмонда (Франция), Р. Остена (Англия), А.А. Бойкова, Н.Т. Гудцова (Россия). Первый вариант диаграммы был построен Маннесманом в 1879г. По мере совершенствования методов исследования диаграмма уточнялась и к концу 20х годов XX века приобрела современный вид. На сегодняшний день имеется более 10000 публикаций по диаграмме и положение основных точек и линий постоянно уточняется.
Железо с углеродом образует ряд химических соединений (карбидов) FeХC, но основным является Fe3C, которому дали имя собственное – цементит. Диаграмму изображают до концентрации углерода равной 6,67%, которая соответствует химическому соединению Fe3C(цементит). Сплавы с более высоким содержанием углерода очень хрупкие и практического интереса не имеют.
Помимо цементита в системе Fe-C происходит выделение углерода в виде графита. Цементит не устойчивая фаза (при нагреве распадается на железо и углерод) по сравнению с графитом, но кинетически образование цементита более вероятно. Поэтому диаграмму железо-цементит называют метастабильной, а диаграмму железо-графит – стабильной.
Компоненты и фазы в сплавах Fe-C
Железо – серебристо-серый металл № 26 периодической системы элементов Д. И. Менделеева, имеет атомную массу равную 55,85 и плотность 7,86 г/см, с температурой плавления 1539 градусов по Цельсию.
Железо в твердом состоянии при атмосферном давлении может находиться в двух полиморфных модификациях: ОЦК (α-железо) при температуре до 910 градусов по Цельсию и в интервале от 1392 до 1539 градусов по Цельсию (δ-железо). Полиморфные превращения в железе обязательно связаны с объёмными изменениями.
У железа существует и магнитное превращение с точкой Кюри равной 768 градусов по Цельсию. Все превращения изображены на кривой нагрева (рис 1).
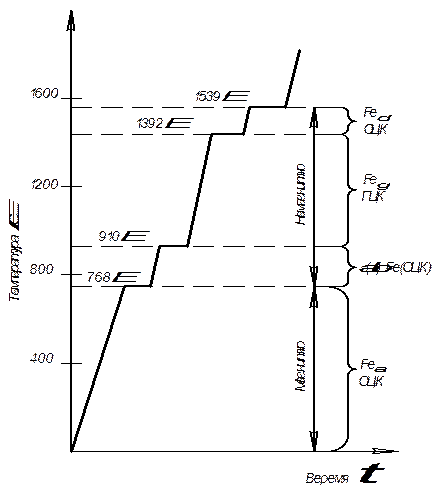
Рис.1. Полиморфные и магнитные превращения в железе.
Железо с углеродом образуют твёрдые растворы, которые имеют собственные имена:
Феррит (Ф) – твёрдый раствор внедрения углерода в α-железе. Различают низкотемпературный (α-феррит) на основе α-железа и высокотемпературный (δ-феррит) на основе δ-железа. Феррит это мягкая пластичная фаза.
Аустенит (А) – твёрдый раствор внедрения углерода в γ-железе. Аустенит пластичен, но прочнее феррита.
Цементит (Ц) – карбид железа Fe3C с содержанием углерода 6,67%. Обладает высокой твёрдостью (≈800HB) и практически нулевой пластичностью. Имеет сложную ромбическую решетку. Температура плавления ≈1260 градусов по Цельсию. При нагреве распадается на железо и углерод.
Графит (Г) – одна из полиморфных модификаций углерода. Имеет гексагональную кристаллическую решетку. Плотность 2,25г/см. Обладает набором уникальных свойств. При 20 градусах по Цельсию это мягкий и очень не прочный материал, но имеет температуру плавления 3500 градусов и с увеличением температуры прочность аномально растёт, и при 2500 градусов является самым прочным материалом на Земле.
Внешний вид метастабильной диаграммы состояний железо-цементит изображен на рисунке 2.
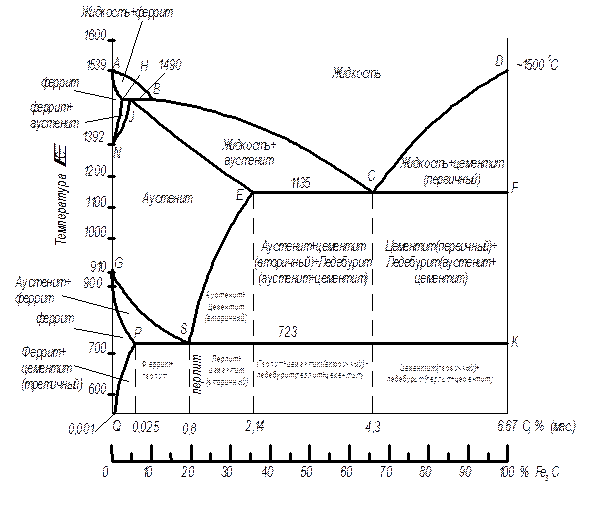
Рис. 2. Метастабильная диаграмма железо – цементит.
 2015-01-30
2015-01-30 849
849








