Вещества, растворы которых в воде и некоторых других диэлектрических жидкостях проводит электрический ток, называют электролитами или проводниками второго рода.
Выясним механизм проводимости водных растворов электролитов на примере раствора поваренной соли NaCI.
Взаимодействие атомов натрия и хлора в молекуле поваренной соли упрощенно можно представить как взаимодействие двух ионов: положительно заряженного иона Na+ и отрицательно заряженного иона CI.- (рис.1). Объясняется это тем, что единственный валентный электрон у натрия слабо связан с атомом. При образовании молекул NaCI. этот электрон переходит к атому хлора, превращая его в отрицательный ион CI.-; в соответствии с этим молекулу NaCI можно схематически изобразить в виде диполя (рис. 2).

Рис.2
При растворении поваренной соли в воде молекулы NaCI попадают в окружение молекул воды, которое тоже являются диполями. В электрическом поле, создаваемом молекулой NaCI, молекулы воды ориентируются так, как показано из рис. 2. При этом они растягивают молекулу NaCI настолько, что незначительная ее встряска при отклонении с другими молекулами разрушает ее. Часть молекул NaCI распадается - диссоциирует на ионы Na+ и CI.-. Этот процесс называется электролитической диссоциацией. Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы – рекомбинировать.
При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся в единицу времени на ионы, равно числу пар ионов, которые за то же время вновь воссоединяющихся в нейтральные молекулы. Другими словами, в водных растворах электролитов всегда имеются в наличии свободные носители зарядов – положительно и отрицательно заряженные ионы.
Если в сосуд с раствором электролита опустить электроды и включить их в электрическую цепь, то отрицательные ионы начнут двигаться к положительному электроду – аноду, а положительные к отрицательному – катоду. В результате устанавливается электрический ток. Поскольку перенос заряда в водных растворах или расплавах электролитов осуществляется ионами, такую проводимость называют ионной.
При прохождении тока, например, через раствор медного купороса СuSO4 происходит следующий процесс. Положительные ионы Сu++ при соприкосновении с катодом получают недостающие электроны и выделяются на катоде в виде нейтральных атомов. Отрицательные ионы (SO4)- - при соприкосновении с анодом отдают лишние электроны. Появившиеся на аноде электроны по внешней цепи переходят на катод и там соединяются с положительными ионами. Если анод медный, то нейтрализовавшиеся ионы SO4 вступают с ними в химическую реакцию и вновь образуют молекулы медного купороса: SO4 + Сu 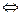 СuSO4
СuSO4 

В результате количество медного купороса в растворе остается неизменным, на катоде выделяется медь, а медь с анода, вступая в химическую реакцию с группой SO4, переходит в раствор.
Процесс выделения на электродах продуктов разложения электролита при прохождении через этот электролит электрического тока, называется электролизом. Согласно первому закону Фарадея, масса выделивщегося на электроде вещества m пропорциональна силе тока I и времени его прохождения t.
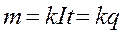 (1)
(1)
где k-коэффициент пропорциональности, а It=q заряд, перенесенный ионами за время t.
Из формулы /1/ видно, что коэффициент k численно равен массе выделившегося на электродах вещества при переносе ионами заряда, равного 1 Кулону. Величину k называют электрохимическим эквивалентом данного вещества. Электрохимический эквивалент выражается в кг/Кл.
Согласно второму закону Фарадея, электрохимический эквивалент вещества пропорционален его химическому эквиваленту 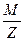 .
.
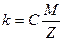 (2)
(2)
где М – молярная масса вещества,
Z – валентность,
С – постоянная величина, одинаковая для всех элементов.
Введя вместо коэффициента С величину, ему обратную, второй закон Фарадея можно переписать в виде:
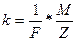 (3)
(3)
где 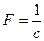 -число Фарадея.
-число Фарадея.
Объединяя формулы /1/и /3/, получим:


Если масса выделившегося вещества равна его химическому эквиваленту, т. е. /m/=/ 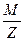 /,то /F/=/q/. Таким образом, число Фарадея F численно равно количеству электричества g, при прохождении которого через электролит на электроде выделяется количество вещества, равное химическому эквиваленту, F=9.6484*104Кл/моль.
/,то /F/=/q/. Таким образом, число Фарадея F численно равно количеству электричества g, при прохождении которого через электролит на электроде выделяется количество вещества, равное химическому эквиваленту, F=9.6484*104Кл/моль.
В настоящей работе требуется определить электрохимический эквивалент меди и число Фарадея.
II. ОПИСАНИЕ ЭКСПЕРИМЕНТАЛЬНОЙ УСИАНОВКИ.
Для определения электрохимических эквивалентов различных веществ пользуются так называемыми вольтметрами. Медный вольтметр состоит из стеклянной банки, в которую налит раствор медного купороса и погружены две пластинки из красной меди, снабженные клеммами для включения их в цепь /см. рис.3/.Электрическое поле между электродами создается с помощью источника тока/аккумулятора, выпрямителя и др./, сила тока регулируется реостатом R и измеряется амперметром А. Цепь замыкается ключом К, время отмечается по часам.
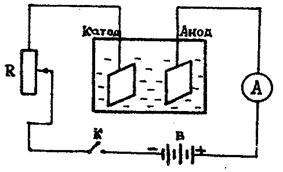
Рис.3
II. Порядок выполнения работы.
1. Зачистите электроды наждачной бумагой, промойте струей воды из под крана и просушите над электроплиткой (электроды должны быть совершенно чистыми).
2. Определите массу одной из пластинок m1 на весах с точностью 0,01 грамма.
3. Соберите схему согласно рис. 3, используя в качестве катода пластинку с известной массой.
4. Замкните цепь ключом К и установите реостатом R силу тока I.
5. Проведите процесс электролиза в течении времени t (сила тока I и время процесса t задается преподавателем).
6. Выньте катодную пластинку, помойте ее струей воды, просушите ее и определите массу m2.
7. Вычислите массу m отложившейся на пластинке меди: m = m2 – m1.
8. Подставляя значения m, I, t в формулу (1), рассчитайте электрохимический эквивалент меди k.
9. Вычислите число Фарадея по формуле: 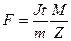 зная, что М = 63,57*10-3 Кл/моль, а z = 2.
зная, что М = 63,57*10-3 Кл/моль, а z = 2.
10. Данные измерений и вычислений занесите в таблицу 1.
11. Сделайте выводы.
Таблица 1
| Масса пластинки m | Масса отложившейся меди, кг | Сила тока, А | Длительность опыта, с | ЭХЭ, кг/Кл | Число Фарадея, Кл/моль | |
| До опыта, г | После опыта, г | |||||
IV. Контрольные вопросы.
1. Что называется электролизом?
2. Что называется степенью диссоциации, электролитической диссоциацией, рекомбинацией?
3. Что такое электролит?
4. Сформулируйте закон Фарадея.
5. Каков физический смысл электрохимического эквивалента, числа Фарадея?
6. В каком случае будет (не будет) изменятся концентрация электролита в процессе опыта?
7. Выведите закон Ома в дифференциальной форме для жидкостей.
 2015-01-30
2015-01-30 1732
1732
