Электролизом называют процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника тока через электролиты.
При электролизе на электродах непрерывно протекают окислительно-восстановительные реакции. На катоде (К(-)) происходит процесс восстановления, на аноде (А(+)) – процесс окисления. Продукты этих реакций или откладываются на электродах, или вступают во вторичные реакции (взаимодействуют между собой, с молекулами растворителя или с веществом электрода), или накапливаются в растворе у электродов. Течение первичных анодных и катодных реакций подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:
m = kQ, но Q =It (9.16)
где I – сила тока, А; t – время пропускание тока, с.
m = kIt (9.17)
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
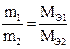
Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно:
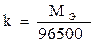
Подставив последнее уравнение в (9.17), получим формулу, объединяющую оба закона Фарадея.
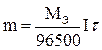 (9.18)
(9.18)
Соотношение (9.18) используют в расчетах процессов при электролизе. При практическом проведении электролиза всегда некоторая часть электрической энергии затрачивается на побочные процессы. Важной характеристикой рентабельности установки для проведения электролиза (электролизера) является выход по току (h, %):
h = 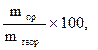 (9.19)
(9.19)
где mпр – масса фактически выделенного вещества; mтеор – масса вещества, которая должна была выделиться в соответствии с законом Фарадея.
На процесс электролиза существенно влияет плотность тока, то есть сила тока, приходящаяся на единицу рабочей поверхности электрода.
Рассмотрим процессы, протекающие на катоде и аноде. Если электролиз идет в расплаве соли, то на катоде выделяется металл, а на аноде газ аниона.
Например, электролиз расплава хлорида натрия приводит к восстановлению ионов Na+ до металлического натрия на катоде (отрицательном электроде)
Na+ + 1e ® Na
и окислению хлорид ионов Cl– до газообразного хлора на аноде (положительном электроде)
Cl– – e ® 1/2 Cl2.
Суммарная реакция:
NaCl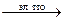 Na + 1/2 Cl2.
Na + 1/2 Cl2.
Если электролиз идет в растворе соли, то помимо катиона металла и аниона в растворе находятся ионы H+ и OH+:
H2O D H++OH-.
При наличии нескольких видов ионов или недиссоциированных молекул электрохимически активных веществ возможно протекание нескольких электродных реакций. На катоде, прежде всего, протекает реакция с наиболее положительным потенциалом. Поэтому при катодном восстановлении возможно три случая:
Катионы металлов, стоящие в ряду напряжения от Li+ до Al3+ включительно не восстанавливаются на катоде, вместо них выделяется водород:
2Н2О + 2e ® Н2 + 2OH-;
Катионы металлов, находящиеся в ряду напряжения от Al3+ до H+ (включительно) восстанавливаются одновременно с молекулами воды, что связано с более высокой поляризацией (перенапряжением) при выделении водорода, чем поляризацией (перенапряжением) разряда многих металлов:
Меn+ + ne ® Ме°
2Н2О + 2e ® Н2 + 2ОН-
Катионы металлов, стоящие в ряду напряжения после водорода полностью восстанавливаются на катоде:
Меn+ + ne ® Ме°.
На аноде в первую очередь реагируют наиболее сильные восстановители – вещества, имеющие наиболее отрицательные потенциалы.
На нерастворимом аноде (уголь, графит, платина, иридий) анионы кислородсодержащих кислот не окисляются, а окисляется вода с образованием кислорода:
2Н2О – 4e ® 4Н+ + О2.
Анионы бескислородных кислот (Cl-, I-, Br-, S2- и т.д.) окисляются до простых веществ (Cl2, I2, Br2, S и т. д.) при высокой плотности тока. При малой плотности тока выделяется только кислород, а при выравнивании потенциала 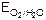 и
и 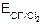 протекают обе реакции.
протекают обе реакции.
На растворимом аноде идет процесс растворения самого анода, например, Сu +- 2e ® Cu2+.
Электролиз применяют в:
1) металлургии для получения меди, цинка, кобальта, марганца и других металлов;
2) в химической промышленности электролизом получают газообразный хлор, водород, кислород, щелочи, окислители (пероксид водорода, перманганат калия, хлораты и другие);
3) получение гальванопокрытий: никелирование, меднение, цинкование, хромирование;
4) электрохимическая анодная обработка металлов и сплавов для придания изделиям определенной формы.
 2014-02-12
2014-02-12 26924
26924








