Иммуноглобулины составляют от 15 до 20% белков плазмы крови.
Структура антител была установлена в 1959 году одновременно Роднейем Портером (Англия, Оксфорд) и Джеральдом Эдельманом (США, Рокфеллеровский университет).
 | |
 |  |
.
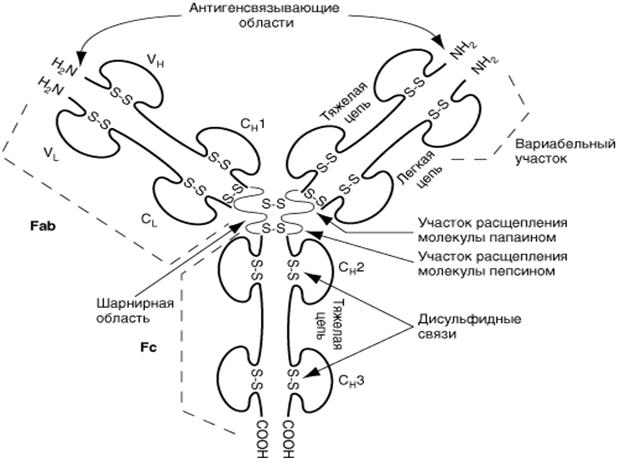
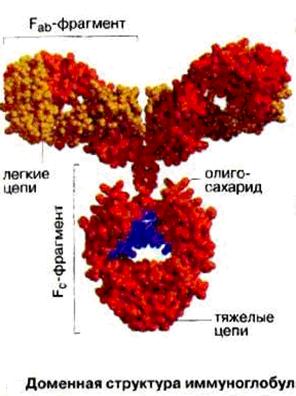
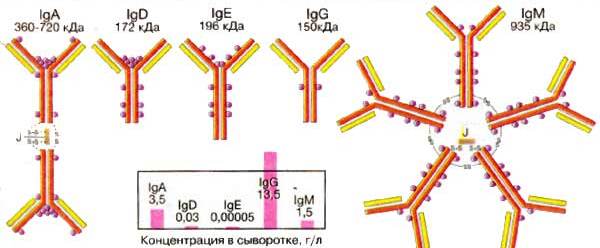
Молекула антитела (Ig G) состоит из двух тяжелых (Н, 50 000·2) и двух легких (L, 20 000-25 000·2) полипептидных цепей, соединенных между собой дисульфидными связями. Тяжелые цепи в антигенном отношении делятся на типы m,g,a,e и d, подразделяя иммуноглобулины на классы M, G, A, E и D. Легкие цепи в любой из этих молекул могут быть одного из двух подклассов – æ или l.
Примечание: Объектом для изучения структуры иммуноглобулинов служили миеломные белки.Миелома – род злокачественной опухоли, когда по неизвестным причинам разрастается клон плазматических клеток, синтезирующих строго одинаковые молекулы g -глобулинов. То есть все плазматические клетки происходят из единственной клетки – родоначальницы клона, и именно поэтому производят совершенно идентичный моноклональный продукт: он гомогенен по классу или Ig M, или Ig G, или Ig A, легкие цепи у всех молекул одного типа – æ или l.
Весь сывороточный g- глобулин больного миеломой представлен единственным вариантим иммуноглобулиновых молекул. При этом легкие цепи синтезируются в избытке и выделяются в чистом виде с мочой (белки Бенс-Джонсона).
Легкие цепи содержат 214 аминокислотных остатков. Первые 107 аминокислотных остатков, начиная с N-конца полипептида, составляют вариабельный участок (V) цепи. Последовательность аминокислот этого участка различна у всех легких цепей. Вторая половина данного полипептида со 108 до 214 аминокислотного остатка практически одинакова у всех легких цепей. Это константный участок (С).
Весь сывороточный g- глобулин больного миеломой представлен единственным вариантим иммуноглобулиновых молекул. При этом легкие цепи синтезируются в избытке и выделяются в чистом виде с мочой (белки Бенс-Джонсона).
Тяжелые цепи также состоят из V и C участков, то есть вариабельных и константных. Константные участки тяжелых цепей в три раза длиннее, чем легких, и представляют собой как бы три повторяющиеся линейно расположенных полипептидных отрезка по 100-110 аминокислотных остатка. Вариабельный участок включает 116 аминокислотных остатков. Всего в каждую тяжелую цепь входит около 450 аминокислот.
Всего структуру иммуноглобулинов представляют 12 доменов (2+2+4+4), молекулярная масса каждого домена примерно 12 500, откуда молекулярная масса всей молекулы Ig G должна быть 150 000. Если же тяжелая цепь состоит из 5-и доменов, как у Ig M, то молекула иммуноглобулина будет тяжелее.
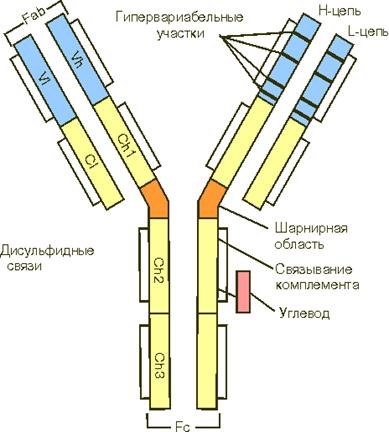
Активные центры антител формируются доменами вариабельных участков. Анализ показывает, что в этом участвует от 4 до 8 аминокислотных остатков, которые относятся к так называемым гипервириабельным областям легких и тяжелых цепей. Таких областей в вариабельных участках тяжелых цепей 4. Они обозначаются как Hhv1-4.
Поскольку активный центр формируется обеими H- и L-цепями молекулы, бесконечное разнообразие специфических антител может определяться не только разнообразием вариабельных цепей, но и комбинацией сочетаний различных цепей. Например, если у одного индивидуума генетически запрограммировано 1 000 вариантов легких и 1 000 вариантов тяжелых цепей, то в разных клетках или клонах клеток сборка антитела может идти путем наработки одного из 1 000 000 возможных сочетаний.
Такое объяснение многообразия специфических антител в настоящее время наиболее принято.
Константные участки цепей ответственны за другие свойства молекулы иммуноглобулинов. В области Сн2 и Сн3 доменов располагаются соответственно участок фиксации комплемента и участок, ответственный за фиксацию антител к клеткам, например к макрофагам, тучным клеткам, лимфоцитам; Сн 4 обеспечивает связывание мономеров в сложные агрегаты.
Константные области тяжелых цепей, будучи различными у разных классов иммуноглобулинов определяют особые биологические функции каждого класса антител:
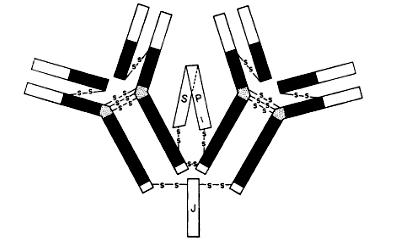
Ig M (5-10% от общего количества) могут активировать систему комплемента, выполняют функцию мембранных рецепторов: 50 000- 150 000 на одну клетку, первыми синтезируются организмом новорожденных, их содержание повышается в течение первой недели и к году (!) достигает уровня взрослых;
 | Ig A (10-15% от общего количества) секретируются в различные жидкости тела и обеспечивают секреторный иммунитет, синтезируются со 2-3-й недели новорожденности; |
Ig E (0,2% от общего количества) прикрепляются к специфическим рецепторам на поверхности тучных клеток и базофилов и, если они связываются с антигеном, из клеток начинают высвобождаться заключенные в них биологически активные вещества, вызывая аллергические явления;
Ig D (0,2% от общего количества) функционируют почти ислючительно в качестве мембранных рецепторов для антигена;
Ig G (75% от общего количества) проявляют разнообразные виды активности, в том числе способность проникать через плацентарный барьер, передаются от матери и сохраняются в организме новорожденного в течение 3-х месяцев, обеспечивая ему естественный пассивный иммунитет; синтезируются в организме ребенка со 2-3 месяца
 |
СL и Сн1-домены определяют аллоантигенные различия молекул атител: здесь реализуется контроль генетических систем аллотипов иммуноглобулинов человека.
Антителообразование увеличивается с развитием лимфоидной ткани, которое происходит в течение первого года жизни и заканчивается лишь к периоду половой зрелости.
Синтез иммуноглобулинов представляет собой частный случай продукции белковых тел. Особенность его состоит в том, что легкие цепи синтезируются на одних РНК-матрицах, а тяжелые – на других. Потом происходит сборка всей молекулы. По-видимому, вначале синтезируется одна пара из легкой (L) и тяжелой (Н) цепей, а затем две молекулы собираются в целую молекулу антитела. Легкие цепи обнаружены в клетке в некотором избытке. Предполагают, что они содействуют снятию тяжелых цепей с лизосом. В случае пентамерных молекул Ig M последним этапом сборки является соединение пяти мономерных молекул в единую структуру, и лишь после этого секреция из клетки.
Генетический анализ изотипов, аллотипов и идиотипов дал возможность сделать три важнейших заключения:
1. Полипептиды, составляющие иммуноглобулиновую молекулу, кодируются тремя не сцепленными группами аутосомных генов. Одна группа (12-ая хромосома) кодирует тяжелую цепь того или иного класса, другая (6-ая хромосома) – легкую цепь æ-типа, третья (16-ая хромосома) – легкую цепь l-типа.
2. Каждая из трех групп генов включает в себя набор генов вариабельных областей (V-гены) и гены константной области (С-гены) полипептидных цепей.
3. Набор V-генов тесно сцеплен с С-генами, т.е. расположен не только на одной хромосоме, но и в непосредственной близости от них.
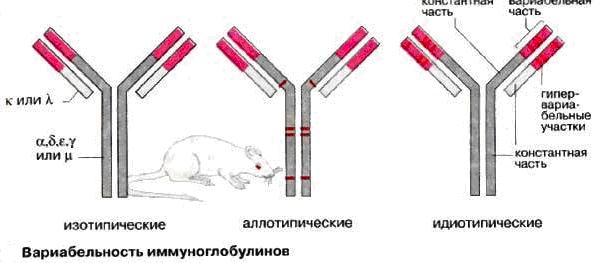
Примечание. В настоящее время общепризнано, что иммуноглобулины обладают антигенными свойствами. В молекулах иммуноглобулинов различают три типа антигенных детерминант (анигенные детерминанты- эпитоп – это область поверхности молекулы антигена, являющаяся в пространственном отношении комплиментарной рецепторной зоне антитела – паратопу):
изотипические детерминанты идентичные для всех особей данного вида;
аллотипические детерминанты внутривидовые, они имеются у одних особей данного вида и отсутствуют у других;
идиотипические детерминанты присущие только антителам, синтезированным данным клоном плазматических клеток.
 |
 2015-01-30
2015-01-30 3867
3867
