Элемент N 17 - это элемент третьего периода - хлор. Его электронная формула в нормальном состоянии
1s22s22p63s23p5.
Поглощая энергию извне, атом хлора может переходить в возбужденное состояние, при этом валентные электроны в пределах одного слоя распределяются по одному в АО (ячейках)

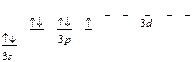
нормальное состояние

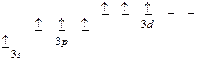
возбужденное состояние
Таким образом, в возбужденном состоянии атом хлора имеет семь не спаренных электронов на внешнем уровне и может иметь степени окисления: +1+2+3+4+5+6+7. Низший оксид: Cl2O, высший - Cl2O7. Их гидроксиды: HOCl, HClO4.
Все гидроксиды имеют одинаковый фрагмент молекулы Н-О-Э, в данном случае Н-1О-2Cl.
Используя значение ОЭО (см. приложение, табл.1), рассчитаем условия полярности связей 1 и 2
∆ОЭО(1)=ОЭО (О) – ОЭО (Н)= 3,5-2,1 = 1,4;
∆ОЭО(2)=ОЭО (О) – ОЭО (Cl)= 3,5-3,0 = 0,5.
Связь 1 более полярна (∆ОЭО(1) > ∆ОЭО(2)), следовательно, она с большей вероятностью будет разрываться в водных растворах и диссоциация гидроксидов будет происходить следующим образом: HСlO=H++ClО-; HClO4= H++ClO4-. Это кислоты.
Помимо значений ОЭО, тип электролитической диссоциации химической связи зависит от степени окисления элемента. Чем она выше, тем сильнее проявляются кислотные свойства гидроксида, поэтому HClO4 диссоциирует сильнее, чем HСlO.
 2015-01-30
2015-01-30 820
820








