1. Определим константу равновесия этой реакции
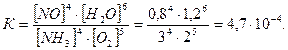
Количество прореагировавшего аммиака и кислорода находим на основании уравнения реакции.
2. Найдем, сколько молей аммиака вступило в реакцию:
на образование 4 моль NO расходуется 4 моль NH3
на образование 0,8моль NO расходуется X моль NH3.
Отсюда
х =0,8·4/4= 0,8 моль/дм3 NH3
3. Найдем исходную концентрацию аммиака
0,8 + 3 = 3,8 моль/дм3;
С нач(NH3 ) = 3,8 моль/дм3
4. Найдем, сколько моль кислорода вступило в реакцию:
на образование 6 моль Н20 расходуется 5 моль 02
на образование 1,2 мольН20 расходуется X моль 02
Отсюда
Х=1,2 · 5/ 6 =1 моль/дм3
5. Найдем исходную концентрацию кислорода
1+2=3 моль/дм3;
С нач(02) = 3 моль/дм3.
Оформим решение в виде следующей таблицы:
| Вещество | Исходная концентрация, моль/дм3 | Количество вещества, вступившего в химическое взаимодействие, моль/дм3 | Текущая концентрация, моль/дм3 |
| NН3 | 3,8 | 0,8 | |
| О2 | |||
| N0 | - | - | 0,8 |
| Н20 | - | - | 1,2 |
Ответ: К = 4,7·10-4; С нач(NH3 ) = 3,8 моль/дм3; С нач (02) = 3 моль/дм3 .
Состояние химического равновесия сохраняется при данных неизменных условиях любое время. При изменении условий равновесие нарушается и смещается в правую или левую сторону. Химическое равновесие называют подвижным. Оно смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций, тем самым нарушая равенство скоростей.
Направление смещения равновесия в общем случае определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия. Влияние изменения условий на положение химического равновесия представлено в табл. 2.1:
Таблица 2.1
Влияние изменения условий на положение химического равновесия
| Условие | Изменение условия | Направление смещения равновесия |
| Температура | Повышается Понижается | В сторону эндо- термической реакции (∆Нr>0). В сторону экзо- термической реакции (∆Нr<0) |
| Давление | Повышается Понижается | В сторону образования меньшего числа молей газообразных вещества. В сторону образования большего числа молей газообразных веществ |
| Концентрация | Повышается Понижается | В сторону реакции, по которой вводимое вещество расходуется. В сторону реакции, по которой образуется вещество, концентрация которого уменьшается |
 2015-01-30
2015-01-30 328
328








