Равновесные концентрации для исходных веществ означают количество вещества (моль/дм3), оставшегося после реакции, а для продуктов реакции - количество вещества (моль/дм3), образовавшегося в результате химической реакции, причем количество вещества, вступившего в химическое взаимодействие и количество образовавшегося продукта реакции находятся между собой в пропорциональной зависимости согласно стехиометрическим коэффициентам реакции.
1. Найдем равновесную концентрацию воды. Из уравнения реакции следует, что:
при получении 2 моль Сl2образуется 2 моль H2О,
при получении 0,5 моль Cl2 образуется X моль Н20.
Отсюда:
х = 0,5·2/2= 0,5 моль/дм3 Н2О;
[Н20] = 0,5 моль/дм3.
2. Найдем число моль кислорода, вступившего в химическое взаимодействие:
из 1 моль О2 образуется 2 моль Cl2;
из X моль 02 образуется 0,5 моль 02
Отсюда
х =1·0,5/2 = 0,25 моль/дм3 О2.
3. Найдем количество моль хлористого водорода, вступившего в реакцию:
из 4 моль HCl образуется 2 моль Cl2;
из X моль HCl образуется 0,5 моль Сl2.
Отсюда
Х = 4·0,5/2=1 моль/дм3 HCl.
4. Определим равновесные концентрации хлористого водорода и кислорода:
[НСl] =3-1=2 моль/дм3;
[02] =2-0,25= 1,75 моль/дм3
.
5. Определим константу равновесия реакции
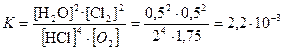
Оформим решение в виде следующей таблицы:
| Вещество | Исходная концентрация, моль/дм3 | Количество вещества, вступившего в химическое взаимодействие, моль/дм3 | Равновесная концентрация, моль/дм3 |
| НСl | |||
| О2 | 0,25 | 1,75 | |
| Н20 | - | - | 0,5 |
| Cl2 | - | - | 0,5 |
 2015-01-30
2015-01-30 600
600








