КРАСНОЯРСКИЙ ИНСТИТУТ ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТА
филиал ФГБОУ ВПО
«Иркутский государственный университет путей сообщения»
Колмаков О.В.
Материаловедение
Электроматериаловедение
Конспект лекций по дисциплине для студентов очной и заочной форм обучения специальности
190901.65 «Системы обеспечения движения поездов»
Красноярск 2010
|
| МОДУЛЬ 1. ФИЗИЧЕСКИЕ ОСНОВЫ ДИЭЛЕКТРИЧЕСКИХ МАТЕРИАЛОВ |
|
Тема 1.1. СТРОЕНИЕ ВЕЩЕСТВА. ВИДЫ СВЯЗИ В ВЕЩЕСТВЕ Как известно из физики, любое вещество состоит из атомов и молекул. Атомом называется наименьшая частица химического элемента, обладающая его химическими свойствами. Атом состоит из положительно заряженного ядра и электронов, заполняющих оболочки атома. Заряд электрона е = -1,6×10-19 Кл. В атоме заряд ядра равен по абсолютной величине суммарному заряду всех его электронов. Ионом данного атома называется электрически заряженная частица, образующаяся при потере или приобретении электрона атомом. 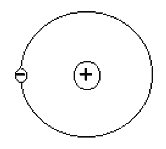 Рис. 1.1. Модель строения атома водорода по теории Бора Простейшей атомной системой является атом водорода (Рис. 1.1) состоящий из одного электрона, движущегося в кулоновском поле одного протона. От структуры электронной оболочки атомов зависят многие свойства веществ, представляющих собой по составу химические элементы. Решающее влияние имеют внешние, наиболее удаленные от ядра электроны. Эти электроны слабее всех связаны с ядром и называются валентными электронами. Слой, в котором находятся эти электроны, называется валентным слоем. Количество электронов в атом слое определяет валентность элемента и его способность соединяться с другими элементами. Атомы в свою очередь могут соединяться в молекулы. Молекулой называется наименьшая частица вещества, обладающая его химическими свойствами и состоящая из одинаковых или различных атомов или ионов. Различают три основных вида связи между атомами в молекулах. Ковалентная связь возникает при обобществлении электронов двумя соседними атомами. Например, атом хлора имеет на внешней оболочке (в валентной зоне) один электрон, а при соединении двух таких атомов молекулу, эти валентные электроны становятся общими. Рис. 1.1. Модель строения атома водорода по теории Бора Простейшей атомной системой является атом водорода (Рис. 1.1) состоящий из одного электрона, движущегося в кулоновском поле одного протона. От структуры электронной оболочки атомов зависят многие свойства веществ, представляющих собой по составу химические элементы. Решающее влияние имеют внешние, наиболее удаленные от ядра электроны. Эти электроны слабее всех связаны с ядром и называются валентными электронами. Слой, в котором находятся эти электроны, называется валентным слоем. Количество электронов в атом слое определяет валентность элемента и его способность соединяться с другими элементами. Атомы в свою очередь могут соединяться в молекулы. Молекулой называется наименьшая частица вещества, обладающая его химическими свойствами и состоящая из одинаковых или различных атомов или ионов. Различают три основных вида связи между атомами в молекулах. Ковалентная связь возникает при обобществлении электронов двумя соседними атомами. Например, атом хлора имеет на внешней оболочке (в валентной зоне) один электрон, а при соединении двух таких атомов молекулу, эти валентные электроны становятся общими. 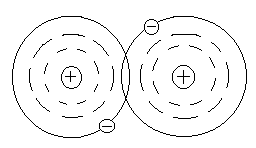 Рис. 1.2. Схематическое изображение двухатомной молекулы с ковалентной связью Если рассмотреть модели атомов (Рис. 1.2), то можно увидеть, что валентный электрон первого атома взаимодействует (притягивается) с положительным ядром второго атома, а электрон второго атома - с ядром первого атома. Это взаимодействие кулоновское, т.е. электрическое. Или иначе, электрон первого ядра находится некоторое время у второго ядра и наоборот. Примерами ковалентных связей могут служить молекулы H2, O2, СО, С2. Ковалентная связь существует не только у газов, например, алмаз представляет соединение атомов углерода (-С-С-), карборунд - углерода и кремния (-Si-С-). Если атом отдает с внешней орбиты электрон, то он превращается в положительный ион. И наоборот, если атом присоединяет лишний электрон, он превращается в отрицательный ион. Ионная связь образована силами притяжения между положительным и отрицательным ионами. При этом общая сумма положительных и отрицательных зарядов ионов в молекуле равна нулю. Силы, обеспечивающие притяжение атомов в ионных молекулах, имеют в основном электрическую природу. Эта связь характерна для соединений неметаллов с металлами, например, ионов натрия Na+ и ионов хлора Сl- или КJ, Аl2О3 и т.д. Ионная связь может существовать лишь для атомов различных химических элементов, так ионы хлора Cl- и Cl- не могут электрически притягиваться. Молекулы бывают нейтpaльные и полярные (дипольные). Если центры тяжести положительных и отрицательных зарядов в молекуле совпадают, молекулу называет нейтральной. У полярных молекул эти центры не совпадают и образуют диполь (Рис. 1.3). Рис. 1.2. Схематическое изображение двухатомной молекулы с ковалентной связью Если рассмотреть модели атомов (Рис. 1.2), то можно увидеть, что валентный электрон первого атома взаимодействует (притягивается) с положительным ядром второго атома, а электрон второго атома - с ядром первого атома. Это взаимодействие кулоновское, т.е. электрическое. Или иначе, электрон первого ядра находится некоторое время у второго ядра и наоборот. Примерами ковалентных связей могут служить молекулы H2, O2, СО, С2. Ковалентная связь существует не только у газов, например, алмаз представляет соединение атомов углерода (-С-С-), карборунд - углерода и кремния (-Si-С-). Если атом отдает с внешней орбиты электрон, то он превращается в положительный ион. И наоборот, если атом присоединяет лишний электрон, он превращается в отрицательный ион. Ионная связь образована силами притяжения между положительным и отрицательным ионами. При этом общая сумма положительных и отрицательных зарядов ионов в молекуле равна нулю. Силы, обеспечивающие притяжение атомов в ионных молекулах, имеют в основном электрическую природу. Эта связь характерна для соединений неметаллов с металлами, например, ионов натрия Na+ и ионов хлора Сl- или КJ, Аl2О3 и т.д. Ионная связь может существовать лишь для атомов различных химических элементов, так ионы хлора Cl- и Cl- не могут электрически притягиваться. Молекулы бывают нейтpaльные и полярные (дипольные). Если центры тяжести положительных и отрицательных зарядов в молекуле совпадают, молекулу называет нейтральной. У полярных молекул эти центры не совпадают и образуют диполь (Рис. 1.3). 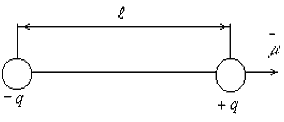 Рис. 1.3. Схематическое изображение диполя Диполем называют два равных, но противоположных по знаку, заряда, центры которых смещены на некоторое расстояние, называемое плечом диполя. Полярные молекулы характеризует величиной дипольного момента m = q×l, где q - суммарный положительный заряд молекулы; l - плечо диполя. Дипольный момент полярной молекулы, как и всякий электрический момент, является векторной величиной. При этом за направление вектора Рис. 1.3. Схематическое изображение диполя Диполем называют два равных, но противоположных по знаку, заряда, центры которых смещены на некоторое расстояние, называемое плечом диполя. Полярные молекулы характеризует величиной дипольного момента m = q×l, где q - суммарный положительный заряд молекулы; l - плечо диполя. Дипольный момент полярной молекулы, как и всякий электрический момент, является векторной величиной. При этом за направление вектора  принимается направление от отрицательного заряда к положительному (как это показано на рис. 1.3). В большинстве случаев собственный дипольный момент полярных молекул бывает порядка 10-30 Кл.м, так как абсолютное значение заряда электрона | е |» 1,6.10-19 Кл, а плечо - порядка 10-10 м. Молекула типичного ионного соединения КJ (йодистый калий), имеет весьма большей электрический момент m = 23×10-30 Кл×м. Направлен этот момент от отрицательного иона J- к положительному иону К+ (Рис. 1.4, а) принимается направление от отрицательного заряда к положительному (как это показано на рис. 1.3). В большинстве случаев собственный дипольный момент полярных молекул бывает порядка 10-30 Кл.м, так как абсолютное значение заряда электрона | е |» 1,6.10-19 Кл, а плечо - порядка 10-10 м. Молекула типичного ионного соединения КJ (йодистый калий), имеет весьма большей электрический момент m = 23×10-30 Кл×м. Направлен этот момент от отрицательного иона J- к положительному иону К+ (Рис. 1.4, а) 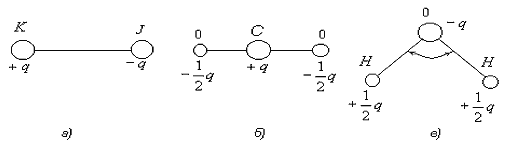 Рис. 1.4. Схема пространственного строения молекулы а) йодистого калия KJ, б) углекислого газа CO2, в) воды H2O По написанию химической формулы нельзя определить полярные молекулы, у данного вещества или нейтральные. Так, формулы углекислого газа (СО2) и воды (Н2О) в записях похожи, но углекислый газ имеет симметричное строение молекул (Рис. 1.4, б) с m = 0, а вода - несимметричное с m =6,1×10-30 Кл×м (Рис. 1.4, в). В результате молекулы углекислого газа нейтральны, а вода имеет резко выраженные полярные свойства. Диэлектрики, состоящие из нейтральных молекул с m = 0, называют неполярными, a диэлектрики, состоящие из дипольных молекул с m > 0, - полярными диэлектриками. Третий вид связи в веществе - металлическая связь. Это связь между положительно заряженными ионами, находящимися в узлах кристаллической решетки, с общими для данного тела "свободными" электронами (Рис. 1.5). Рис. 1.4. Схема пространственного строения молекулы а) йодистого калия KJ, б) углекислого газа CO2, в) воды H2O По написанию химической формулы нельзя определить полярные молекулы, у данного вещества или нейтральные. Так, формулы углекислого газа (СО2) и воды (Н2О) в записях похожи, но углекислый газ имеет симметричное строение молекул (Рис. 1.4, б) с m = 0, а вода - несимметричное с m =6,1×10-30 Кл×м (Рис. 1.4, в). В результате молекулы углекислого газа нейтральны, а вода имеет резко выраженные полярные свойства. Диэлектрики, состоящие из нейтральных молекул с m = 0, называют неполярными, a диэлектрики, состоящие из дипольных молекул с m > 0, - полярными диэлектриками. Третий вид связи в веществе - металлическая связь. Это связь между положительно заряженными ионами, находящимися в узлах кристаллической решетки, с общими для данного тела "свободными" электронами (Рис. 1.5). 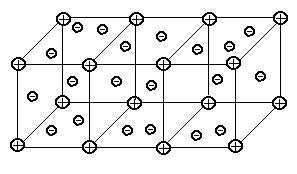 Рис. 1.5. Схема строения металлического проводника. Наличие "свободных" электронов приводит к высокой электропроводности металлов. В общем можно сказать, что существует очевидная связь между типом связей атомов в молекулах и свойствами материалов. Существовало представление, что молекулы являются очень малыми частицами. Это не всегда правильно, так как размеры молекул различных материалов различаются на много порядков. Некоторые молекулы действительно очень малы и их размеры сравнимы с размерами атомов. Например, размер молекулы воды имеет порядок 2,7×10-10 м. Но многие молекулы имеют макроскопические размеры. Кристаллы и термореактивные пластмассы в отвержденном состоянии представляют собой гигантские макромолекулы. Контрольные вопросы 1. Какие силы удерживают атомы в молекулах? 2. Перечислите основные виды связи в веществе. 3. Чем отличаются нейтральные молекулы от полярных? Рис. 1.5. Схема строения металлического проводника. Наличие "свободных" электронов приводит к высокой электропроводности металлов. В общем можно сказать, что существует очевидная связь между типом связей атомов в молекулах и свойствами материалов. Существовало представление, что молекулы являются очень малыми частицами. Это не всегда правильно, так как размеры молекул различных материалов различаются на много порядков. Некоторые молекулы действительно очень малы и их размеры сравнимы с размерами атомов. Например, размер молекулы воды имеет порядок 2,7×10-10 м. Но многие молекулы имеют макроскопические размеры. Кристаллы и термореактивные пластмассы в отвержденном состоянии представляют собой гигантские макромолекулы. Контрольные вопросы 1. Какие силы удерживают атомы в молекулах? 2. Перечислите основные виды связи в веществе. 3. Чем отличаются нейтральные молекулы от полярных? |
|
Тема 1.2. ПОЛЯРИЗАЦИЯ ДИЭЛЕКТРИКОВ 1.2.1. Электрическое поле 1.2.2. Поляризация диэлектриков в электрическом поле 1.2.3. Основные виды поляризации диэлектриков 1.2.4. Поляризация комбинированных диэлектриков 1.2.5. Диэлектрическая проницаемость газов 1.2.6. Диэлектрическая проницаемость жидких диэлектриков 1.2.7. Диэлектрическая проницаемость твердых диэлектриков Контрольные вопросы 1.2.1. Электрическое поле Если в пространстве существуют электрические силы, обнаруживающиеся при внесении в него электрических зарядов, то мы говорим, что в нем существует электрическое поле. Источником электрического поля является заряженное тело любой формы, неподвижное относительно измерителя. Основной характеристикой электрического поля служит вектор напряженности электрического поля 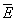 . Напряженность электрического поля характеризует силу, с которой поле действует на помещенный в него заряд q . Напряженность электрического поля характеризует силу, с которой поле действует на помещенный в него заряд q 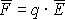 . Направления векторов . Направления векторов 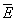 в электрическом поле изображаются силовыми линиями напряженности. Так называются линии, в каждой точке которых вектор в электрическом поле изображаются силовыми линиями напряженности. Так называются линии, в каждой точке которых вектор 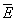 направлен по касательной. В зависимости от формы заряженных тел (электродов), и их взаимного расположения графики распределения силовых линий могут иметь самый различный вид (Рис. 2.1). направлен по касательной. В зависимости от формы заряженных тел (электродов), и их взаимного расположения графики распределения силовых линий могут иметь самый различный вид (Рис. 2.1). 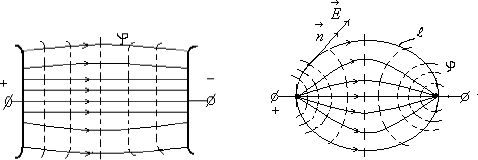 Рис. 2.1. Простейшие картины электрического поля Силовые линии при этом проводятся нормально к поверхностям равного потенциала называемым, эквипотенциальными Обычно силовые линии рисуются так, чтобы число силовых линий на единицу площади эквипотенциальной поверхности было в среднем равно Рис. 2.1. Простейшие картины электрического поля Силовые линии при этом проводятся нормально к поверхностям равного потенциала называемым, эквипотенциальными Обычно силовые линии рисуются так, чтобы число силовых линий на единицу площади эквипотенциальной поверхности было в среднем равно 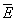 в данной точке поля. Напряженность поля в данной точке поля. Напряженность поля 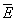 в заданной точке равна скорости изменения потенциала, т.е. падению напряжения на единицу длины l вдоль силовой линии, и направлена в сторону снижения потенциала. Это выражается равенством в заданной точке равна скорости изменения потенциала, т.е. падению напряжения на единицу длины l вдоль силовой линии, и направлена в сторону снижения потенциала. Это выражается равенством 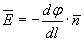 , где , где 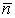 - единичный вектор, направленный по силовой линии поля в данной точке (Рис. 2.1). 1.2.2. Поляризация диэлектриков в электрическом поле Одним из важнейших свойств диэлектриков является их способность поляризоваться под действием внешнего электрического поля. Понятие "поляризации" впервые было введено М.Фарадеем еще в тридцатых годах XIX века. Фарадей проводил простые опыты с помощью электроскопа и конденсатора, состоящего из двух параллельных металлических пластин. Его опыты показали, что если между пластинами поместить изолятор (диэлектрик), то емкость такого конденсатора возрастет в εr раз. Причем εr зависит только от свойств изоляционного материала. Эта величина εr получила название относительной диэлектрической проницаемости. Относительная диэлектрическая проницаемость представляет собой отношение заряда Q при некотором напряжении на конденсаторе, изготовленном из данного диэлектрика, к заряду Q0, который можно было бы получить в конденсаторе тех же размеров и при том же напряжении, если бы между электродами находился вакуум: - единичный вектор, направленный по силовой линии поля в данной точке (Рис. 2.1). 1.2.2. Поляризация диэлектриков в электрическом поле Одним из важнейших свойств диэлектриков является их способность поляризоваться под действием внешнего электрического поля. Понятие "поляризации" впервые было введено М.Фарадеем еще в тридцатых годах XIX века. Фарадей проводил простые опыты с помощью электроскопа и конденсатора, состоящего из двух параллельных металлических пластин. Его опыты показали, что если между пластинами поместить изолятор (диэлектрик), то емкость такого конденсатора возрастет в εr раз. Причем εr зависит только от свойств изоляционного материала. Эта величина εr получила название относительной диэлектрической проницаемости. Относительная диэлектрическая проницаемость представляет собой отношение заряда Q при некотором напряжении на конденсаторе, изготовленном из данного диэлектрика, к заряду Q0, который можно было бы получить в конденсаторе тех же размеров и при том же напряжении, если бы между электродами находился вакуум:
где Q д - дополнительный заряд, обусловленный поляризацией вещества. Учитывая, что заряд конденсатора Q = C·U, можно получить еще одну формулу, выражающую εr через значения емкостей:
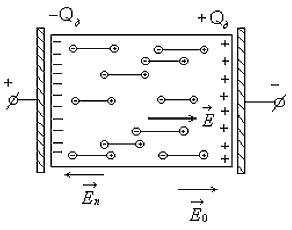
где С - емкость конденсатора с диэлектриком; Со - емкость конденсатора, когда между его обкладками находится вакуум. Из формулы (2.1) следует, чем интенсивней процессы поляризации в диэлектрике, тем больше дополнительный заряд Q д и соответственно больше εr . Поэтому относительная диэлектрическая проницаемость характеризует интенсивность процессов поляризации, протекающих в диэлектриках под действием приложенного электрического поля. Выясним, в чем заключается физическая сущность поляризации диэлектриков, В предыдущей главе было показано, что в диэлектрике всегда имеются связанные между собой электрические заряды. Такими связанными зарядами являются: ядро атома и электроны; положительные и отрицательные ионы, входящие в состав молекул, и дипольные молекулы, у которых электрические центры разноименных зарядов не совпадают. При воздействии электрического поля связанные электрические заряды смещается друг относительно друга, а дипольные молекулы еще и ориентируются (занимают определенное положение) в соответствии с направлением действия поля. Это явление смещения связанных зарядов и ориентации дипольных молекул, происходящее в диэлектрике под действием внешнего электрического поля, получило название "поляризации". Поляризация приводит к образованию некоторого электрического момента как у каждой отдельной поляризующейся частицы (атома, иона, молекулы), так и у всего объема диэлектрика (Рис. 2.2). При этом внутри диэлектрика существует два электрических поля: поле с напряженностью
Но поскольку векторы
Отсюда следует, что поляризация приводит к уменьшению напряженности электрического поля в диэлектрике по сравнению с вакуумом. Причем можно доказать, что уменьшение результирующего поля в диэлектрике зависит только от относительной диэлектрической проницаемости εr материала, а именно
 Сейчас читают про:
|
 2015-01-30
2015-01-30 3192
3192
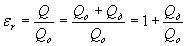 ,
, 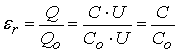 ,
,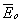 , созданное пластинами и поле с напряженностью
, созданное пластинами и поле с напряженностью 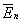 , созданное поляризационным зарядом диэлектрика Q д (Рис. 2.2). Суммарное поле этих двух источников определяется вектором напряженности
, созданное поляризационным зарядом диэлектрика Q д (Рис. 2.2). Суммарное поле этих двух источников определяется вектором напряженности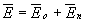 .
.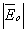 и
и 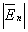 :
: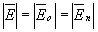 .
.
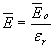 .
.





