Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ.
При взаимодействии раствора тиосульфата натрия с фосфорной кислотой в осадок выпадает сера, вызывающая при определенной концентрации помутнение раствора:
3 Na2S2O3 + 2H3РO4 = 3H2O + 3SO2 + 3S↓+ 2Na3РO4
По промежутку времени от начала реакции до заметного помутнения раствора можно судить об относительной скорости этой реакции. Необходимо измерить по секундомеру время от момента сливания до появления едва заметной мути. Зная время протекания реакции (число секунд), легко определить скорость реакции, т.к. последняя является величиной, обратной времени:
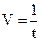
В три пробирки налейте: в первую - 6 мл р-ра Na2S2O3, во вторую - 4 мл р-ра Na2S2O3 и 2 мл Н2О, в третью - 2 мл р-ра Na2S2O3 и 4 мл Н2О. В три другие пробирки налейте по 6 мл раствора фосфорной кислоты. Сгруппируйте попарно пробирки с кислотой и тиосульфатом. Слейте первые две пробирки с растворами Na2S2O3 и H3РO4, приливая во всех случаях кислоту к раствору тиосульфата, и тотчас же, включив секундомер, перемешайте растворы в пробирке, зажав её отверстие большим пальцем и опрокидывая дном кверху и обратно. Как только замечаете появление слабой мути, выключите секундомер. Полученные результаты внесите в таблицу 2.
Таблица 2 - Результаты опыта 1
| № | Объём, мл | Относительная концентрация | Время по секундомеру | Скорость реакции | ||
| Na2S2O3 | H2O | H3РO4 | ||||
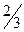 | ||||||
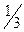 |
По полученным данным постройте на миллиметровой бумаге график зависимости между скоростью реакции (ось ординат) и концентрацией (ось абсцисс). Определите по графику скорость реакции и время протекания реакции при относительной концентрации тиосульфата натрия, равной 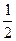 .
.
Опыт 2. Зависимость скорости реакции от температуры.
В три пробирки налейте по 4 мл тиосульфата натрия, в три другие пробирки по 4 мл фосфорной кислоты. Сгруппируйте попарно пробирки кислота – тиосульфат. Поместите первую пару пробирок в стакан с горячей водой с тем, чтобы растворы приняли температуру воды. Отметьте температуру воды, затем слейте вместе содержимое пробирок и одновременно включите секундомер. Точно отметьте время от начала реакции до помутнения. Поместите вторую пару пробирок в этот же стакан и понизьте температуру в стакане на 10оС, добавляя из другого стакана холодную воду, и через 2-3 мин слейте вместе содержимое пробирок и измерьте время до появления мути. Повторите опыт с третьей парой пробирок, понизив температуру ещё на 10о. Результаты внесите в таблицу 3:
Таблица 3 - Результаты опыта 2
| N п/п | Температура опыта | Время, сек | Скорость реакции |
Постройте график зависимости скорости реакции от температуры, откладывая на оси абсцисс температуру, а на оси ординат – скорость.
Каков температурный коэффициент скорости данной реакции? Определите скорость данной реакции, если температуру повысить от 40о до 80о.
Опыт 3. Зависимость скорости реакции от катализатора.
Добавьте в пробирку с 10 мл воды по 2-3 капли растворов роданида калия и хлорида железа (Ш). Раствор образовавшегося роданида железа красного цвета разлейте в две пробирки поровну. В две другие пробирки налейте по 5 мл тиосульфата натрия, во вторую добавьте ещё 2 капли сульфата меди. Сгруппируйте попарно пробирки роданид железа – тиосульфат натрия. Слейте содержимое первой пары пробирок, одновременно включив секундомер. Как только исчезнет красная окраска, секундомер остановите. Реакция протекает:
2Fe(CNS)3 + 2Na2S2O3 = 2Fe(CNS)2 + 2NaCNS + Na2S4O6
Проведите опыт со второй парой пробирок, отмечая время по секундомеру, от момента сливания до исчезновения красной окраски. Результаты опыта внесите в таблицу 4:
Таблица 4 - Результаты опыта 3
| N | Объем взятых растворов, мл | Время, сек | Скорость реакции | ||
| Fe(CNS)3 | Na2S2O3 | CuSO4 | |||
| - | |||||
| 2 капли |
1. Какую роль в реакции играют ионы Cu2+?
2. Влияет ли количество катализатора на скорость реакции?
На основании проделанных опытов и полученных результатов сделайте выводы о влиянии условий на скорость химических реакций.
Контрольные вопросы
1) Что понимается под скоростью химической реакций?
2) В каких единицах измеряется скорость?
3) Какие внешние параметры влияют на скорость химической реакции?
4) Что такое энергия активации?
5) Почему в присутствии катализатора энергия активации уменьшается?
6) Какие виды катализа различают? Чем они отличаются друг от друга?
7) Реакция идет по уравнению 2NO + O2 = 2NO2. Концентрации исходных веществ были: [NO] = 0,03 моль/л; [O2] = 0,05 моль/л. Как изменится скорость реакции, если увеличить концентрацию кислорода до 0,10 моль/л и концентрацию NO до 0,06 моль/л?
 2015-01-30
2015-01-30 1595
1595
