Скорость химической реакции при данной температуре пропорциональна произведению концентраций реагирующих веществ в степени, равной стехиометрическому коэффициенту, стоящему перед формулой данного вещества в уравнении реакции.
Закон действия масс справедлив только для наиболее простых по своему механизму реакций взаимодействия, протекающих в газах или в разбавленных растворах.
Для гомогенных реакций:
1. aA(Ж) + bB(Ж) ↔ cC(Ж) + dD(Ж) ; 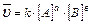 (T=const)
(T=const)
2. 3H2(Г) + N2(Г) ↔ 2NH3(Г); 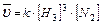
Для гетерогенных реакций:
1. aA(т) + bB(Г) = cC(Г) + dD(Г); 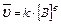 2. С (т)+О2(Г)=СО2(Г);
2. С (т)+О2(Г)=СО2(Г); 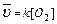
В законе действия масс не учитываются концентрации веществ, находящихся в твердой фазе. Чем больше площадь поверхности твердой фазы, тем выше скорость химической реакции.
k – константа скорости химической реакции определяется природой реагирующих веществ и зависит от температуры, от присутствия в системе катализатора, но не зависит от концентрации реагирующих веществ. Константа скорости представляет собой скорость химической реакции (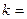
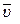 ), если концентрации реагирующих веществ
), если концентрации реагирующих веществ 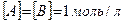 .
.
3. Зависимость скорости химической реакции от давления. Для газообразных систем увеличение давления или уменьшение объема, равноценно увеличению концентрации и наоборот.
Задача: Как изменится скорость химической реакции 2SO2(г) + O2(г) 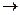 2SO3(г), если давление в системе увеличить в 4 раза?
2SO3(г), если давление в системе увеличить в 4 раза?
В соответствие с законом действия масс для прямой реакции, записываем выражение:
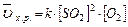 , пусть [SO2] = a моль/л, [O2] = b моль/л, тогда по закону действия масс
, пусть [SO2] = a моль/л, [O2] = b моль/л, тогда по закону действия масс 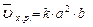
Уменьшение объема в 4 раза соответствует увеличению концентрации в системе в 4 раза, тогда:
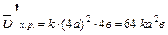 ;
;
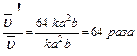 .
.
Влияние температуры на скорость химической реакции приближенно определяется правилом Вант-Гоффа. При повышении температуры на 100С скорость химической реакции возрастает в 2-4раза.
Математическая запись правила Вант-Гоффа: γ - температурный коэффициент скорости реакции или коэффициент Вант-Гоффа 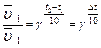 для большинства реакций лежит в пределах 2-4.
для большинства реакций лежит в пределах 2-4.
Задача. Во сколько раз изменится скорость химической реакции, протекающей в газовой фазе, если температура изменилась от 80 0С до 120 0С (γ = 3)?
В соответствии с правилом Вант-Гоффа записываем:
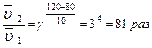
Увеличение скорости химической реакции при повышении температуры объясняется не только увеличением кинетической энергии взаимодействующих молекул. Например, число столкновений молекул растет пропорционально корню квадратному из абсолютной температуры . При нагревании веществ от нуля до ста градусов по Цельсию, скорость движения молекул возрастает в 1,2 раза
. При нагревании веществ от нуля до ста градусов по Цельсию, скорость движения молекул возрастает в 1,2 раза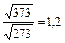 , а скорость химической реакции возрастает примерно в 59 тысяч раз. Такое резкое увеличение скорости реакции с ростом температуры объясняется долей активных молекул, столкновения которых приводит к химическому взаимодействию. Согласно теории активных столкновений в реакцию вступают только активные молекулы, энергия которых превышает среднюю энергию молекул данного вещества, т.е. молекулы, обладающие энергией активации.
, а скорость химической реакции возрастает примерно в 59 тысяч раз. Такое резкое увеличение скорости реакции с ростом температуры объясняется долей активных молекул, столкновения которых приводит к химическому взаимодействию. Согласно теории активных столкновений в реакцию вступают только активные молекулы, энергия которых превышает среднюю энергию молекул данного вещества, т.е. молекулы, обладающие энергией активации.
Энергия активации (EА) – это тот избыток энергии по сравнению со средним запасом, которым должны обладать молекулы для осуществления химической реакции. Если ЕА< 40 кДж/моль – реакции протекают быстро, если ЕА > 120 кДж/моль – реакции не идут, если ЕА = 40-120 кДж/моль – реакции протекают в обычных условиях. Повышение температуры снижает энергию активации, делает вещества более реакционно-способными, скорость взаимодействия при этом увеличивается.
Более точную зависимость скорости химической реакции от температуры установил C. Аррениус: константа скорости реакции пропорциональна основанию натурального логарифма, возведенного в степень (–ЕА/RT). 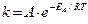 ,
,
А – предэкспоненциальный множитель, определяет число активных соударений;
е – экспонента (основание натурального логарифма).
Логарифмируя выражение 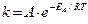 , получим уравнение:
, получим уравнение:
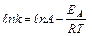 . Уравнение Аррениуса показывает, что скорость реакции тем выше, чем меньше энергия активации. Для снижения энергии активации используют катализаторы.
. Уравнение Аррениуса показывает, что скорость реакции тем выше, чем меньше энергия активации. Для снижения энергии активации используют катализаторы.
 2014-02-02
2014-02-02 9458
9458
