Основы диаграммы Fe – C были созданы Д.К.Черновым, который в 1868 г. впервые установил существование критических точек железа и зависимости температуры этих точек от содержания углерода в сплаве. В последующие годы Ф.Осмонду удалось измерить эти температуры, и с использованием разработанной Д.Гиббсом теории фазовых равновесий Р. Аустен в 1899 г. построил первую диаграмму состояния Fe – C. Несколько позже более полный, близкий к современному вид диаграммы представил Г.Розенбум, после чего продолжались ее исследования, вносились поправки и уточнения.
Ж е л е з о занимает положение в IV периоде, в 8 группе и имеет порядковый номер 26 периодической системы Д.И.Менделеева, оно является переходным металлом и обладает переменной валентностью.
В чистом железе, полученном лабораторными методами рафинирования, его содержание достигает 99,9917 %, плотность составляет 7874 кг/м3, температура плавления равна 1539оС. В техническом железе промышленного получения его содержание составляет 99,9%.
Твердость железа зависит от степени его чистоты и у чистого железа равна 490 НВ, у технического – около 900 НВ. Предел прочности железа при растяжении составляет sв = 300…350 МПа, относительное удлинение – d = 40%, сужение – y = 70%, т.е. железо относится к числу высокопластичных материалов.
Важнейшим свойством железа является полиморфизм, дающий возможность упрочнять его сплавы посредством термической обработки. В условиях обычного давления изменения температуры обусловливают полиморфные превращения железа и его существование в двух кристаллических модификациях: Fea или Fed, а также Feg.
Низкотемпературная модификация Fea, устойчивая при температурах ниже 910оС, и высокотемпературная Fed, устойчивая при температурах выше 1392оС, имеют одинаковую кристаллическую решетку типа ОЦК с периодом а = 2,86Å для Fea и а = 2,93 Å для Fed. В области температур ниже точки Кюри, соответствующей 768оС, железо обладает ферромагнитными свойствами, выше точки Кюри железо парамагнитно.
Модификация Feg сохраняет стабильность в интервале температур от 910оС до 1392оС и обладает решеткой типа ГЦК с величиной периода а = 3,64Å. Элементарная ячейка Feg имеет повышенную компактность, ее объем меньше объема ячейки Fea примерно на 1%.
Переход железа при изменении температуры из одной модификации в другую происходит под влиянием изменения запаса свободной энергии в соответствии со вторым законом термодинамики. Эти процессы перестройки кристаллической решетки сопровождаются при охлаждении выделением тепла, а при нагревании поглощением его, чем обеспечивается постоянство температуры процесса превращения. Магнитное превращение не связано с переходом атомов и образованием новой кристаллической решетки, поэтому выделение либо поглощение тепла происходит в узком интервале температур. За счет указанных тепловых эффектов на кривых охлаждения и нагревания железа при полиморфных превращениях наблюдаются остановки температуры (рис. 26).
Критические точки, соответствующие остановкам на кривых, по предложению Ф.Осмонда обозначаются буквой А от французского слова «arret» – остановка. На кривой охлаждения к этой букве добавляется буква r от французского “refroidissement» – охлаждение, на кривой нагрева – буква с от французского «chauffage» – нагревание. Согласно очередности превращений в процессе нагревания, обозначениям критических точек присваивается номер в виде индекса, начиная с точки магнитного превращения: Ас2, Ас3, Ас4. Обозначение Ас1 присвоено критической точке эвтектоидного равновесия сплавов Fe – C при температуре 727оС.
У г л е р о д представляет неметаллический элемент II периода, 8 группы, занимая 6 место в периодической системе Д.И.Менделеева с температурой плавления около 3500оС. Углерод обладает полиморфизмом и может существовать в двух основных модификациях: графит и алмаз.
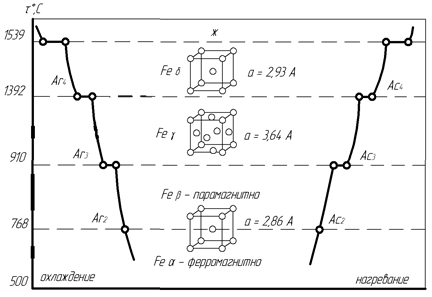
Рис. 26. Кривые охлаждения и нагревания железа
Графит имеет решетку типа ГПУ с очень малым атомным радиусом, составляющим 0,7Å, благодаря чему образуются сплавы типа твердого раствора внедрения С в железе. Плотность графита невелика и равна 2500 кг/м3, его прочность и твердость находятся также на невысоком уровне. Графит сохраняет стабильность в широком диапазоне давлений и температур, только под воздействием очень высоких их значений порядка 100 тыс. атм и 3000оС происходит полиморфная перестройка в кубическую решетку алмаза.
Алмаз обладает плотностью 3500 кг/м3, по твердости он превосходит все известные природные материалы. При обычном давлении и нагреве до температур выше 1200оС алмаз теряет свою стабильность и превращается в графит.
В системе Fe – C образуются несколько основных фаз и равновесных структур.
Ф а з ы системы Fe – C включают жидкий расплав, феррит, аустенит, цементит, графит.
Жидкая фаза (Ж) представляет неограниченный раствор железа и углерода с равномерным распределением их атомов при наличии металлической связи между ними за счет валентных электронов.
Феррит (Ф) – это твердый раствор внедрения углерода в Fea c решеткой ОЦК, в которой при обычной температуре может растворяться не более 0,006% С, при температуре 727оС растворимость достигает максимальной величины 0,02 %. Высокотемпературный феррит образуется как твердый раствор углерода в Fed c максимальной растворимостью 0.1% С при температуре 1499оС. Атом углерода размещается в центре грани решетки ОЦК, а также в вакансиях и дислокациях структур Fea и Fed.
До температуры точки Кюри (768оС) феррит является ферромагнитным, с повышением температуры он переходит в парамагнитное состояние.
Механические свойства феррита близки к свойствам технического железа: твердость – 800 НВ, прочность – σв = 250 МПа, пластичность – d = 50%.
Аустенитом (А) называют твердый раствор внедрения углерода в Feg c решеткой ГЦК и размещением атома углерода в центре объема элементарной ячейки. Максимальная растворимость углерода в Feg составляет 2,14% при температуре 1147оС, что значительно превышает предельное содержание углерода в феррите. Это объясняется тем, что межатомное пространство, необходимое для наиболее благоприятных условий внедрения атома углерода, в решетке ГЦК представляет центр ячейки с размерами намного больше, чем центр грани в решетке ОЦК.
Твердость аустенита составляет 2000 НВ, прочность – σв = 800 МПа, пластичность – d = 25%.
Цементит (Ц) является карбидом железа Fe3C со сложной плотноупакованной ромбической решеткой. Он содержит 6,67 % С и обладает метастабильностью (неустойчивостью) так, что при нагреве еще до температуры плавления 1260оС начинается его распад с образованием стабильных фаз железа и углерода. Межатомные связи в решетке цементита имеют металлический и ковалентный характер, и это придает ему типичные для промежуточной фазы высокую твердость 10000 НВ и отсутствие пластичности. До температуры 210оС цементит проявляет слабые ферромагнитные свойства, при более высоких температурах он переходит в парамагнитное состояние.
Графит (Г) выделяется в виде фазовых включений в структуре железоуглеродистых сплавов при их затвердевании в случае медленного охлаждения.
Равновесные структурные составляющие системы Fe – C – это ледебурит и перлит.
Ледебурит (Л), названный в честь немецкого ученого А.Ледебура, является эвтектической смесью кристаллических зерен аустенита и цементита. Он возникает при завершении кристаллизации жидкой фазы при температуре 1147оС и содержании в ней углерода более 2,14%. Жидкая фаза затвердевает с образованием и взаимным прорастанием цементитных пластин и аустенитных дендритов в равном количественном соотношении так, что концентрация углерода в ледебурите составляет 4,3%.
Механические свойства ледебурита обусловлены высоким содержанием углерода, а также его структурным состоянием и характеризуются большой твердостью 7000 НВ и повышенной хрупкостью.
Перлит (П) образуется в результате полиморфного превращения аустенита в феррит и диффузионного обогащения углеродом прилегающих аустенитных слоев, чем создаются пластины цементита. Эти превращения представляют эвтектоидный распад аустенита так, что перлит является эвтектоидной смесью зерен феррита и цементита, содержащей 0,8% С. Указанные процессы протекают в сплавах с концентрацией углерода более 0,02% при температуре 727оС.
Механические свойства перлитной структуры определяются наличием в ней смеси зерен мягкого феррита и твердого цементита, что придает перлиту благоприятное сочетание твердости 2200 НВ, прочности σв = 900 МПа, пластичности d = 20%.
Железоуглеродистые сплавы с концентрацией углерода более 5% становятся малопрочными и высокохрупкими, поэтому не имеют технического значения. Из-за этого на оси концентраций диаграммы в качестве предельного содержания углерода принята величина 6,67%, соответствующая его концентрации в цементите.
Диаграмма состояния железоуглеродистых сплавов может рассматриваться в двух вариантах: как метастабильная система Fe – Fe3С и как стабильная система Fe – C. Это связано с тем, что при замедленном охлаждении сплавов углерод кристаллизуется с образованием химического соединения в виде цементита, а при очень медленном охлаждении выделяется свободный графит из жидкофазного, твердофазного растворов, а также при распаде цементита. Этот процесс называется графитизацией сплавов, чему способствует также присутствие в сплаве графитизирующих добавок Si, Ni, Al.
В системе Fe – Fe3C фазовые равновесия и структурные состояния на диаграмме характеризуются сплошными линиями, в системе Fe – C –пунктирными линиями (рис. 27).
Д и а г р а м м а Fe – Fe3C на левой вертикальной оси, соответствующей 100% чистого железа, имеет характерные точки превращений железа:
точка А с температурой 1539оС – затвердевание расплавленного железа с образованием кристаллов Feδ,
точка N с температурой 1392оС – полиморфное превращение Feδ в Feγ,
точка G с температурой 910оС – полиморфное превращение Feδ в Feα.
На правой вертикальной оси, отвечающей 6,67% углерода в цементите, находится точка D с температурой 1260оС – затвердевание расплавленного цементита с образованием его кристаллов.
На горизонтальной оси диаграммы рассматриваются значения концентраций углерода, соответствующие превращениям в сплавах:
точка Q с концентрацией 0,006% С – предельная растворимость углерода в Feα при обычной температуре,
точка P на диаграмме при концентрации 0,02%С – предельная растворимость углерода в Fα при эвтектоидной температуре 727оС,
точка H на диаграмме при концентрации 0,1%С – предельная растворимость углерода в Feδ при перитектической температуре 1499оС, когда из жидкости и твердой фазы кристаллизуется другая твердая фаза, и подобный процесс называется перитектическим превращением,
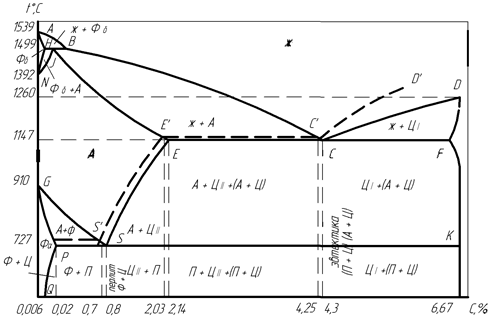
Рис. 27. Диаграмма состояния сплавов железо – углерод
точка J на диаграмме при концентрации 0,16%С – предельная растворимость углерода в Feγ при перитектической температуре 1499оС,
точка B на диаграмме при концентрации 0,51%С – перитектическое равновесие жидкости с δ-ферритом и аустенитом при температуре1499оС,
точка S на диаграмме при концентрации 0,8% С – эвтектоидное равновесие аустенита с ферритом и цементитом при эвтектоидной температуре 727оС,
точка E на диаграмме при концентрации 2,14%С – предельная растворимость углерода в Feγ при эвтектической температуре 1147оС,
точка C на диаграмме концентрации 4,3%С – эвтектическое равновесие жидкости с аустенитом и цементитом при эвтектической температуре 1147оС,
точка F на диаграмме при концентрации около 6,3%С – возможная предельная растворимость железа в цементите.
Процессы затвердевания сплавов при охлаждении разделяются на два основных этапа: первичная кристаллизация из жидкого состояния и вторичная кристаллизация, представляющая фазовые и структурные превращения сплавов в твердом состоянии благодаря полиморфизму железа.
Первичная кристаллизация жидких сплавов начинается при охлаждении до температур ниже ликвидуса ABCD и протекает в соответствии с изменением концентрации углерода.
При концентрации до 0,15%С из жидкости выделяются кристаллы 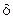 -феррита по линии AB, и, если концентрация не превышает 0,1%С, вся жидкость кристаллизуется по солидусу AH с образованием
-феррита по линии AB, и, если концентрация не превышает 0,1%С, вся жидкость кристаллизуется по солидусу AH с образованием 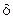 -феррита.
-феррита.
С увеличением концентрации от 0,1%С до 0,16%С жидкость приобретает перитектические свойства и вместе с 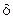 -ферритом образует по солидусу HJ при перитектическй температуре 1499оС смесь кристаллов аустенита и
-ферритом образует по солидусу HJ при перитектическй температуре 1499оС смесь кристаллов аустенита и 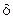 -феррита.
-феррита.
Когда концентрация составляет 0,1%С в точке J перитектическая жидкость вместе с 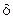 -ферритом кристаллизуется в аустенит.
-ферритом кристаллизуется в аустенит.
При дальнейшем повышении концентрации до 0,51%С жидкость вместе с
δ - ферритом по линии JB перитектической температуры 1499оС превращается в жидкость с аустенитом, последующее охлаждение приводит к завершению кристаллизации жидкости по солидусу JE с образованием аустенита.
Сплавы, содержащие от 0,51 до 2,14%С, начинают затвердевание по ликвидусу BC при выделении кристаллов аустенита и завершают кристаллизацию по солидусу JE с получением аустенита.
При концентрации свыше 2,14%С жидкость приобретает эвтектические свойства, и, если концентрация не превышает 4,3%С, то при охлаждении сплавы начинают затвердевать по ликвидусу BC, заканчивают кристаллизацию по солидусу EC с эвтектической температурой 1147оС, образуя кристаллы аустенита, а также претерпевая эвтектический распад жидкости. При этом из жидкости состава точки C формируются аустенит состава точки E и ледебуритная эвтектика, содержащая аустенит и цементит состава точки F, сплав получившейся структуры называется доэвтектическим:
Ж С ®А Е +Л(А Е +Ц F).
Концентрация жидкости, равная 4,3%С и называемая эвтектической, позволяет ей при охлаждении сохранять устойчивость до самой низкой температуры 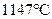 в точке С, при которой она испытывает эвтектический распад:
в точке С, при которой она испытывает эвтектический распад:
Ж С ®Л(А Е +Ц F).
Если концентрация превышает 4,3% С, то при охлаждении эвтектическая жидкость начинает затвердевать с образованием кристаллов первичного цементита ЦI по ликвидусу CD. Наименование «первичный» присвоено самой высокотемпературной данной цементитной фазе в соответствии с очередностью ее последующего выделения из сплавов Fe – C при понижении температуры. Заканчивается кристаллизация по солидусу CF с эвтектической температурой 1147 0С формированием кристаллов первичного цементита и эвтектическим распадом жидкости, чем создается заэвтектический сплав:
Ж С ®Ц1+Л(А Е +Ц F).
Таким образом, первичная кристаллизация сплавов Fe – C из жидкого состояния завершается по солидусу AHGECF с образованием однофазных структур 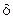 -феррита при малых концентрациях до 0,1%С и аустенита при концентрациях от 0,1 до 2,14%С, а также двухфазных структур, содержащих аустенит и цементит, когда концентрация превышает 2,14%С, с характерной составляющей в виде эвтектики.
-феррита при малых концентрациях до 0,1%С и аустенита при концентрациях от 0,1 до 2,14%С, а также двухфазных структур, содержащих аустенит и цементит, когда концентрация превышает 2,14%С, с характерной составляющей в виде эвтектики.
Сплавы, содержащие до 2,14%С и затвердевшие с образованием только структур твердых растворов в виде 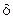 -феррита либо аустенита, имеющие высокую пластичность, называются сталями. В горячем и холодном состояниях они обладают ковкостью и хорошо поддаются обработке давлением.
-феррита либо аустенита, имеющие высокую пластичность, называются сталями. В горячем и холодном состояниях они обладают ковкостью и хорошо поддаются обработке давлением.
При содержании углерода свыше 2,14% в затвердевших сплавах формируется легкоплавкая эвтектика с повышенной хрупкостью, и сплавы называются чугунами. В расплавленном состоянии эвтектика придает чугунам хорошие литейные свойства, что обусловливает высокое качество чугунных отливок. Если графит при этом находится в химически связанном состоянии в виде цементита, то чугуны называют «белыми», они имеют большую твердость и хрупкость. Присутствие структурно свободного графита улучшает прочность чугунов и обеспечивает их широкое применение под названием «серые чугуны».
Вторичная кристаллизация затвердевших сплавов происходит при их охлаждении до температур ниже солидуса AHGECF с протеканием их фазовых и структурных изменений в твердом состоянии, обусловленных полиморфными превращениями железа и изменением растворимости углерода в его модификациях.
Сплавы аустенитного состава с концентрацией углерода до 0,02%, соответствующей точке Р, начинают перестройку в феррит по линии GS, называемой также «линией критических температур АсЗ», и заканчивают ее по линии GP. Дальнейшее охлаждение феррита уменьшает растворимость в нем углерода так, что по линии PQ из феррита выделяется третичный цементит ЦIII, и ниже линии PQ сплав содержит фазы феррита и третичного цементита. Количество и влияние третичного цементита невелико, и в структуре сплавов с более высоким содержанием углерода его присутствие не учитывается.
При концентрациях сплавов свыше 0,02%С, аустенит приобретает способность к эвтектоидному распаду при температуре 727°С на линии PSK, имеющей название «линия критической температуры Ас1». Если концентрация сплавов не превышает 0,8%С, то они называются доэвтектоидными, и в них аустенит начинает перекристаллизацию в феррит по линии GS с обогащением углеродом остающегося аустенита. На линии Ас1 с температурой 727°С концентрация углерода в аустените достигает этектоидной величины 0,8%, и в результате вместе с образованием феррита происходит эвтектоидный распад аустенита с формированием эвтектоида – перлита, имеющего ферритно-цементитный состав:
A S ®Ф Р +П(Ф Р +Ц К).
Концентрация сплава, равная 0,8% С, называется эвтектоидной и обусловливает устойчивость аустенита до самой низкой температуры 727°С в точке S. При ее достижении сплав претерпевает эвтектоидный распад:
А S ®П(Ф Р +Ц К)
В случае увеличения концентрации углерода от 0,8 до 2,14%С сплав называется заэвтектоидным и его охлаждение вызывает снижение растворимости углерода в аустените. Поэтому по линии SE, называемой линией критических температур Aсm, происходит выделение из аустенита вторичного цементита ЦII. Аустенит при этом обедняется углеродом до концентрации 0,8%, и при достижении температуры 7270С на линии Ас 1 наряду с образованием цементита протекает эвтектоидный распад аустенита:
A S® Ц П+ П(Ф Р+ Ц К)
Сплавы, содержащие более 2,14%С, в процессе остывания до температуры 727°С линии Ас1 выделяют из аустенита вторичный цементит, а также испытывают этектоидный распад аустенита с образованием перлита. Это происходит как со структурно свободным аустенитом, так и с входящим в состав ледебуритной эвтектики, которая в таком случае именуется «высокотемпературным ледебуритом».
Доэвтектические сплавы в результате указанных процессов полиморфного превращения железа при окончательном охлаждении ниже температуры 7270С линии Ас1 приобретают структуру перлита, вторичного цементита и так называемого низкотемпературного ледебурита П+Ц П +Л(П+Ц).
Эвтектический сплав в данных условиях получает структуру низкотемпературного ледебурита Л(П+Ц).
Заэвтектические сплавы характеризуются структурой первичного цементита и низкотемпературного ледебурита Ц1+Л(П+Ц).
Д и а г р а м м а Fe – C определяет фазовые и структурные превращения в сплавах при очень медленном охлаждении, когда диффузионные и другие процессы обеспечивают кристаллизацию графита из жидкого сплава, его выделение из твердого раствора или в результате распада цементита (рис.26). Образующиеся структуры сплавов соответствуют характеристикам серых чугунов.
Жидкий сплав начинает затвердевать с образованием первичного графита при заэвтектической концентрации углерода более эвтектической величины 4,25% по линии C/D/. Заканчивается кристаллизация по линии C/F/ эвтектической температуры 1153°С, где жидкость испытывает эвтектический распад, формируя аустенитно-графитную эвтектику. Доэвтектические сплавы с концентрацией более 2,03%С точки E/ начинают кристаллизацию по линии BE/ и заканчивают ее по той же эвтектической линии E/C/ с образованием такой же аустенитно-графитной эвтектики.
Твердый раствор углерода в Feg – аустенит с концентрацией более 0,7%С, под влиянием снижения растворимости углерода при охлаждении выделяет вторичный графит по линии E/S/ так, что в результате образуются фазы аустенита и графита.
В процессе дальнейшего охлаждения получившихся аустенитно-графитовых структур до температуры ниже 738°С линии P/S/K/ происходит полиморфное превращение аустенита в феррит. Благодаря этому окончательная структура сплавов с концентрацией до 2,03%С становится феррито-графитовым эвтектоидом, при более высоких концентрациях – феррито-графитовой эвтектикой.
Цементит, присутствующий в структуре белых чугунов при кристаллизации сплавов системы Fe – Fe3C, подвергается распаду на аустенит и графит за счет нагрева и выдержки при температуре около 1000°С. После окончательного охлаждения структура также получает состав феррито-графитовой эвтектики.
Кроме феррито-графитового фазового состояния, в серых чугунах могут возникать другие, более прочные фазово-структурные составляющие в зависимости от степени графитизации аустенита и вида образующейся металлической основы.
Влияние углерода и постоянных примесей на фазовый, структурный состав
и свойства железоуглеродистых сплавов
Стали и чугуны содержат, кроме основных компонентов – железа и углерода, ряд постоянных примесей, попадающих в сплавы в процессе их выплавки: Mn, Si, S, P, O, H, N, которые приводят к значительному изменению фазового состава, структуры и свойств сплавов. Для регулирования этих характеристик при выплавке применяются металлургические методы ограничения содержания примесей.
У г л е р о д в сплавах после охлаждения находится в составе феррита и цементита. Так как феррит содержит ничтожно мало углерода, то с увеличением концентрации углерода в сплавах прямо пропорционально возрастает количество цементита: при 0,8%С его доля составляет 12%, при 2,0%С доля цементита равна 30%, а при 4%С количество цементита достигает 60%. Поскольку цементит является твердой и хрупкой фазой, то с ростом концентрации углерода у сталей и белых чугунов увеличиваются твердость, пределы прочности и текучести, электросопротивление, уменьшаются плотность, пластичность, ударная вязкость, теплопроводность и магнитная проницаемость.
К р е м н и й и м а р г а н е ц, в виде примесей составляющие долю около 0,5%, вступают при выплавке в реакцию с оксидами железа, окисляются и переходят в шлак, способствуя раскислению стали и улучшению ее прочности. Поэтому кремний и марганец считаются положительными примесями.
С е р а создаёт в сплавах химическое соединение FeS, которое образует с железом легкоплавкую эвтектику с температурой плавления 9880С. При нагреве стали до температур 1000-12000С и горячей обработке давлением такая эвтектика расплавляется, вызывая появление разрывов и трещин, что называется «красноломкостью» стали. Кроме того, сернистые соединения в сталях снижают пластичность, ударную вязкость и предел выносливости, ухудшают коррозионную стойкость и свариваемость. Поэтому сера относится к вредным примесям и ее содержание в сталях не должно быть более 0,05%.
Ф о с ф о р растворяется в феррите, искажая его кристаллическую решетку, что увеличивает пределы прочности и текучести с одновременным уменьшением пластичности и появлением хрупкости. Особенно сильно возрастает хрупкость из-за содержания фосфора при температурах ниже нуля, что называется «хладноломкостью». Вследствие этого фосфор так же, как и сера является вредной примесью, его количество в сталях ограничивается величиной 0,05%.
К и с л о р о д и а з о т мало растворимы в феррите и образуют в сталях химические соединения в виде структурных включений оксидов и нитридов. Скапливаясь на границах зерен, эти включения снижают пластичность и предел выносливости сталей, увеличивают их красно- и хладноломкость.
В о д о р о д может присутствовать в твердом растворе либо в свободном состоянии как скопления в микронесплошностях структуры стали. Растворившийся при выплавке водород сильно уменьшает пластичность стали, придавая ей хрупкость. В процессе охлаждения водород выделяется из раствора и создает высокие давления, что вызывает внутренние разрывы стали – флокены, резко снижающие её качество.
Все газовые включения относятся к вредным примесям, из-за чего допускается их содержание в стали не более 0,05%.
К л а с с и ф и к а ц и я сталей предусматривает их разделение на несколько классов в зависимости от химического состава, фазового и структурного строения, а также от вида важнейших свойств с применением стандартной маркировки.
Наибольшее влияние на характеристики сталей оказывает их химический состав, в соответствии с которым различают два основных класса.
1. Углеродистые стали, содержащие, кроме железа и углерода, только примеси и разделяемые по концентрации углерода на виды:
а) малоуглеродистые с количеством углерода до 0,25%,
б) среднеуглеродистые, имеющие углерод в количестве от 0,25% до 0,6%,
в) высокоуглеродистые с концентрацией углерода свыше 0,6%.
2. Легированные стали, которые имеют специально введенные легирующие добавки элементов, придающие дополнительные свойства, и по массовой доле легирующих элементов разделяют на виды:
а) низколегированные, содержащие до 2,5% элементов,
б) среднелегированные с количеством элементов от 2,5 до 10%,
в) высоколегированные, имеющие свыше 10% легирующих элементов.
 2014-10-30
2014-10-30 9201
9201
