6.1 Способы выражения концентрации растворов
Растворами, как известно, называют термодинамически устойчивые однородные системы, состоящие из двух и более компонентов (растворенных веществ и растворителя). Растворенные вещества – это компоненты раствора, которые меняют свое агрегатное состояние при его образовании. Растворитель – вещество, не изменяющее своего агрегатного состояния при образовании раствора.
Наиболее широкое распространение получили водные растворы (растворителем в которых является вода).
Количественной характеристикой, определяющей состав любого раствора, является концентрация. Концентрация выражает относительное содержание растворенного вещества в растворе. Различают процентную, нормальную, молярную и моляльную концентрации. Рассмотрим способы их выражения на конкретном примере.
Пример 1. В 2-х л воды растворено 40 г карбоната калия. Вычислите 1) процентную; 2) молярную; 3) нормальную; 4) моляльную концентрации полученного раствора, плотность которого равна 1,02 г/см3.
Решение.
Расчет процентной концентрации
Процентная концентрация определяет процент растворенного вещества в растворе, т.е. число граммов растворенного вещества, содержащихся в 100 г раствора, и выражается в %.
С % = 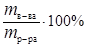 , (17)
, (17)
где m в-ва – масса растворенного вещества, г;
m р-ра – масса раствора, г.
Отношение w К 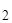 СО
СО  =
= 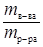 называется массовой долей. Поэтому С% = w ×100%.
называется массовой долей. Поэтому С% = w ×100%.
Рассчитаем массу раствора. Т.к. плотность воды близка к 1 г/см3, то принимаем массу воды равной m 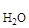 = 2000 мл × 1 г/мл = 2000г, тогда:
= 2000 мл × 1 г/мл = 2000г, тогда:
m р-ра = m 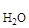 + m
+ m 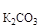 = 2000 + 40 = 2040 г.
= 2000 + 40 = 2040 г.
Процентная концентрация раствора составит:
С% = 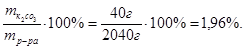
 2015-01-30
2015-01-30 3312
3312








