Согласно второму закону термодинамики каждый атом стремиться образовать максимальное число химических связей, т.к. при этом снижается общее энергосодержание системы. Гибридизация атомных орбиталей позволяет атому образовать большее количество связей. Атом углерода может образовать 4 ковалентные связи только при наличии 4х неспаренных электронов, которые образуются в результате распаривания 2s2 электронов и перехода одного s-электрона на р- подуровень.
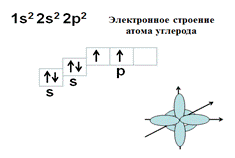
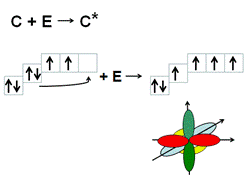
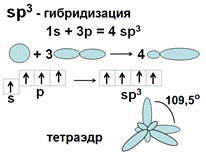
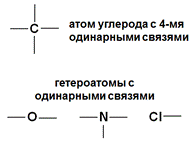
Однако, 4 негибридных неспаренных электрона еще не могут образовать 4 связи. Для этого они должны иметь одинаковую форму АО и располагаться на одинаковом расстоянии от ядра атома. Это происходит после гибридизации АО - выравнивания электронных орбиталей по форме и энергии. В результате sp3 –гибридизации одна s и три р- АО образуют 4 одинаковых по форме и энергии АО в виде неправильной объемной «восьмерки».Они располагаются на максимальном расстоянии друг от друга и образуют тетраэдр с валентным углом 109,5°. В результате атом углерода может образовать 4 одинарных связи, азота – три, кислорода – 2.
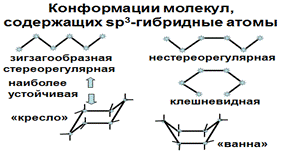
Таким образом, пространственное строение органических молекул, образованных sp3 -гибридными атомами определяется тетраэдрическим строением каждого атома и различными геометрическими формами, которые возникают в результате вращения атомов вокруг одинарных связей (т.н. конформациями). Конформации ациклических молекул могут быть зигзагообразными стереорегулярными, нестереорегулярными и клешневидными. В первом случае возникает наиболее термодинамически выгодное состояние молекулы, так как расстояние между соседними атомами становится максимальным. Циклические соединения: 6-членный циклогексан может иметь конформации «кресло» и «ванна». Конформация «кресло» наиболее стабильная, все атомы максимально удалены друг от друга.
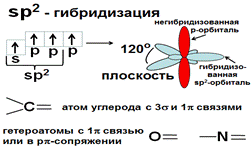
При sp2 –гибридизации одна s и две р- АО образуют 3 sp2- гибридных АО, четвертая р- АО остается негибридной. Гибридные орбитали располагаются под углом 120° и образуют плоскость, негибридная р- орбиталь располагается перпендикулярно плоскости (рис.).
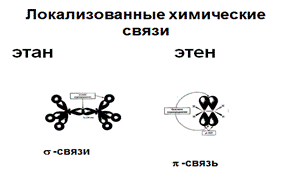
Химические связи. s-Связь возникает при осевом перекрывании любых АО, p-связипри боковом перекрывании р-орбиталей. Онимогут быть локализованными (этан и этен) и делокализованными. В делокализованной связи электроны принадлежат более, чем двум атомам. Делокализованные связи прочнее локализованных так как в результате делокализации:
- возрастает энтропийный фактор S,
-снижается энергия Гиббса G,
-молекула переходит в более устойчивое состояние.

ОСНОВЫ МАРКЕТИНГА
 2014-10-30
2014-10-30 371
371







