Для полного объяснения всех свойств атома была выдвинута гипотеза о наличии у электрона так называемого спина. Спин — это чисто квантовое свойство электрона, не имеющее классических аналогов. С пин — это собственный момент импульса электрона, не связанный с движением в пространстве. Для полного описания состояния электрона в атоме необходимо к трем квантовым числам n, l, m добавить еще одно - спиновое квантовое число (спин) S. Для всех электронов абсолютное значение спина всегда равно s = ½. Это квантовое число определяет ориентацию собственного момента количества движения электрона на некоторое направление, например, на направление орбитального момента электрона. Наличие спина приводит к удвоению состояний электрона в атоме. Спин не имеет классического аналога, это такое же внутреннее свойство электрона, как его заряд и масса.
Спин – неотъемлемое свойство микрочастицы, особая степень свободы. Для описания этого свойства ему в соответствие приводится механический момент 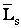 . Спиновый (собственный) момент электрона есть вектор
. Спиновый (собственный) момент электрона есть вектор 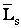 , у которого определены только модуль и одна из проекций:
, у которого определены только модуль и одна из проекций:
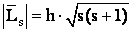 (10)
(10)
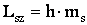 (11)
(11)
где: 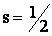 (12)
(12)
(спиновое квантовое число для электрона, принимающее единственное значение ½).
Проекция спина на ось z(магнитное спиновое число ms) может иметь лишь два значения:
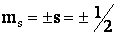 (13)
(13)
(магнитное спиновое квантовое число, принимающее 2 значения).
В соответствии с (12,13) вектор 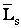 для электрона относительно выделенного направления (ось z) может ориентироваться лишь двумя способами (пространственное квантование).
для электрона относительно выделенного направления (ось z) может ориентироваться лишь двумя способами (пространственное квантование).
 2015-01-30
2015-01-30 1195
1195
