Выход продукта реакции (по массе) 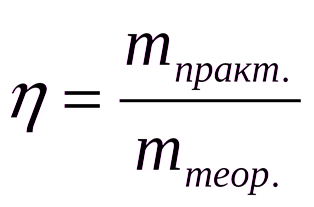 | Выход продукта реакции (по объёму) 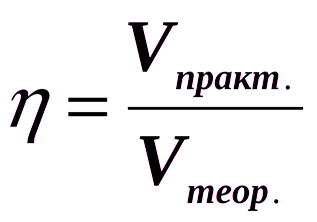 | Массовая доля растворённого вещества в растворе 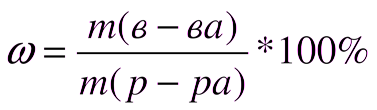 |
Количество вещества для газов 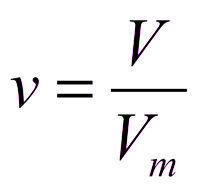 Vm – молярный объём, объём 1 моль любого газа при н.у. (равен 22,4 л/моль) Vm – молярный объём, объём 1 моль любого газа при н.у. (равен 22,4 л/моль) | Молярная концентрация вещества в растворе 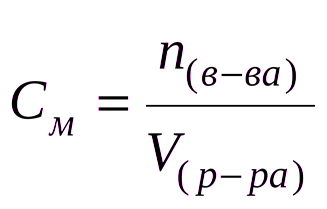 | Массовая доля компонента в смеси (системе) 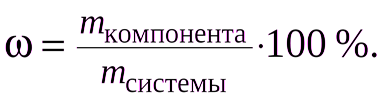 |
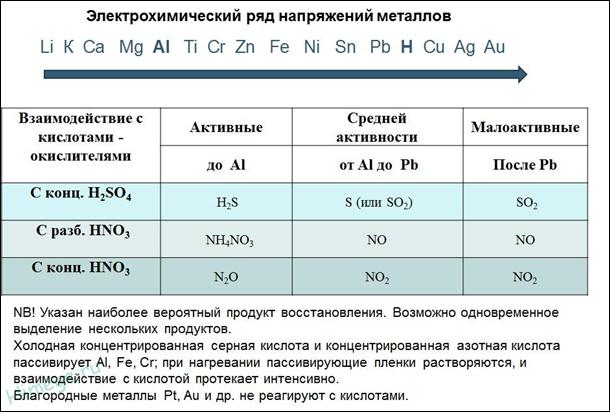

Разложение нитратов при нагревании  |

Уравнение Клапейрона-Менделеева 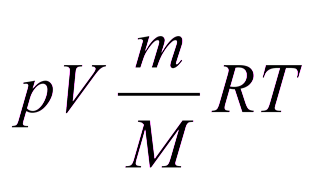 R – универсальная газовая постоянная Т – температура в Кельвинах (Т = t° (в градусах Цельсия) + 273) R – универсальная газовая постоянная Т – температура в Кельвинах (Т = t° (в градусах Цельсия) + 273)
| |||||||||
Универсальный газовый закон 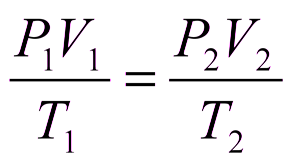 | Закон Бойля-Мариотта (при постоянной температуре) 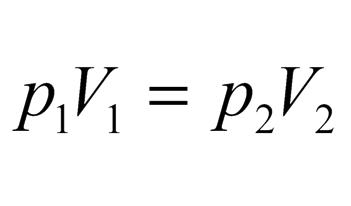 | Закон Гей-Люссака (при постоянном давлении) 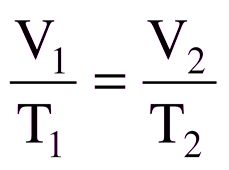 |
Закон Шарля (при постоянном объёме) 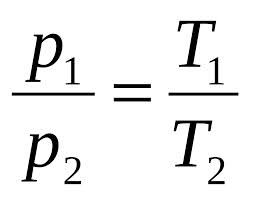 | Нормальные условия (н.у.): ü Нормальное давление (1 атм (атмосфера), или 760 мм рт.ст. (миллиметры ртутного столба), или 101 325 Па (паскаль) ≈ 101,3 кПа (килопаскаль) ü Нормальная температура (0°С, или 273 К (ноль градусов Цельсия, или 273 градуса по шкале Кельвина) | Относительная плотность газа 1 по газу 2 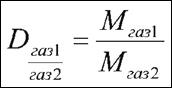 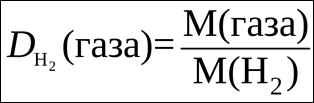 М (воздуха) = 29 г/моль М (воздуха) = 29 г/моль |
Количество вещества (обозначается буквами “ν” (“ню”) или “n” (“эн”) 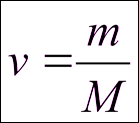 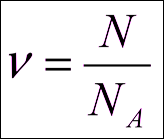 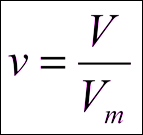 |
Vm – молярный объём, объём 1 моль любого газа при н.у. (равен 22,4 л/моль) NA – число Авогадро – число молекул (атомов) в одном моле любого вещества 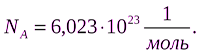 |
 2015-01-30
2015-01-30 5080
5080






