Любое вещество характеризуется своим электрическим сопротивлением (R). Величина обратная сопротивлению называется электропроводностью или электрической проводимостью (G). Для раствора электролита, находящегося между двумя электродами, площадь поверхности которых равна S и расстояние между которыми равно 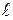 :
:
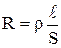
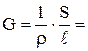 Å
Å 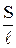
где Å- удельная электропроводность раствора
В аналитических целях G не используется, так как она зависит от размеров и формы проводника. Удельная электропроводность, характеризующая лишь токопроводящую среду, не зависит от этих параметров.
Размерность R - Ом, G - См (сименс) = Ом-1, r - Ом×см (в СИ Ом×м), Å - См×см-1 (в СИ См×м-1). Удельная электропроводность (См×м‑1) численно равна силе тока, проходящего через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1В на единицу длины.
Удельная электропроводность связана с молярной концентрацией эквивалента вещества (моль/л):
Å = 1×10-3lС,
где l - молярная (эквивалентная) электропроводность (См×см2/моль)
При малых и средних концентрациях (до 2-4 моль/л) удельная электропроводность раствора прямо пропорциональна молярной концентрации электролита в растворе. При больших концентрациях эта зависимость отклоняется от прямолинейной, а при концентрациях больше 8-10 моль/л удельная электропроводность раствора начинает даже уменьшаться. При бесконечном разбавлении раствора величина удельной электропроводности стремится к нулю.
Молярная электропроводность равна произведению абсолютной скорости движения иона на постоянную Фарадея. При уменьшении концентрации электролита и уменьшении ионной силы скорости движения ионов возрастают, поэтому величина l увеличивается. При бесконечном разбавлении молярная электропроводность достигает некоторого предельного (ненулевого) значения, называемого предельной молярной электропроводностью 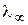 . Согласно закону Кольрауша:
. Согласно закону Кольрауша:
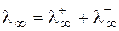
Значения 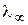 для некоторых ионов приведены в табл. 25.2.
для некоторых ионов приведены в табл. 25.2.
Табл. 25.2
Значения 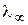 для некоторых катионов и анионов
для некоторых катионов и анионов
| Катион | 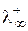 , См×см2/моль , См×см2/моль
| Анион | 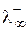 , См×см2/моль , См×см2/моль
|
| H3O+ | OH- | 197,0 | |
| NH4+ | 73,7 | Br- | 78,1 |
| Ag+ | 61,9 | Cl- | 76,4 |
| 1/2Ca2+ | 59,8 | NO3- | 71,5 |
| Na+ | 50,1 | CH3COO‑ | 40,9 |
Самую высокую 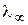 среди катионов имеет катион гидроксония, а среди анионов - гидроксид-ион. Это связано с их способностью передавать свой заряд через молекулы растворителя по особому «эстафетному» механизму, на что затрачивается значительно меньше времени, чем для непосредственного перемещения к электроду.
среди катионов имеет катион гидроксония, а среди анионов - гидроксид-ион. Это связано с их способностью передавать свой заряд через молекулы растворителя по особому «эстафетному» механизму, на что затрачивается значительно меньше времени, чем для непосредственного перемещения к электроду.
 2015-01-07
2015-01-07 542
542








