Таблица 4 – Диссоциация кислот и оснований
| Кислоты | Основания |
| 1. Сильные HCl → H+ + Cl‾ H2SO4 → H+ + HSO4‾ HSO4‾↔ H+ + SO42- 2. Слабые H3PO4 ↔ H+ + H2PO4‾ H2PO4‾ ↔ H+ + HPO42- HPO42- ↔ H+ + PO43- | 1. Сильные 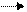 NaOH Na+ + ОН- 2. Слабые Fe(OH)3 ↔ OH‾ + Fe(OH)2+ Fe(OH)2+ ↔ OH‾ + (FeOH)2+ (FeOH)2+ ↔ OH‾ + Fe3+ NaOH Na+ + ОН- 2. Слабые Fe(OH)3 ↔ OH‾ + Fe(OH)2+ Fe(OH)2+ ↔ OH‾ + (FeOH)2+ (FeOH)2+ ↔ OH‾ + Fe3+ |
Выводы:
1. Кислоты – электролиты, которые в водных растворах диссоциируют на катионы водорода и анионы кислотных остатков.
2. Основания – электролиты, которые в водных растворах диссоциируют на катионы металла и анионы гидроксогрупп (OH‾).
3. Сильные многоосновные кислоты и многокислотные основания по первой ступени диссоциируют необратимо, а далее – обратимо (ступенчато).
4. Слабые многоосновные кислоты и многокислотные основания диссоциируют ступенчато и обратимо.
 2015-01-07
2015-01-07 743
743







