1. Сильные многоосновные кислоты (HnX) в водных растворах диссоциируют полностью по уравнению:
HnX → nH + + Xn-
следовательно: [Н+] = n C(HnX) и рН = -lgn C(HnX)
Пример сильной двухосновной кислоты – серная кислота H2SO4. Например, в 0,1 М растворе H2SO4:
H2SO4 → 2H + + SO4 2- рН = -lg2 C(H2SO4) = -lg0,2 = 0,7.
2. Слабые многоосновные кислоты (HnA) в водных растворах диссоциируют ступенчато и каждой ступени диссоциации отвечает своя ступенчатая константа кислотной диссоциации Kai. При этом величина каждой последующей константы превышает значение предыдущей. Например, для двухосновных слабых кислот Н2А процессы диссоциации выглядят следующим образом:
I ступень: Н2А ↔ Н+ + НА- 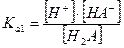 - первая константа диссоциации
- первая константа диссоциации
II ступень: НА- ↔ Н+ + А2- 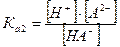 - вторая константа диссоциации
- вторая константа диссоциации
Ka1 > Ka2, так как положительно заряженному иону водорода легче оторваться от нейтральной молекулы кислоты, чем от отрицательно заряженного гидроаниона.
В таблице приведены ступенчатые константы диссоциации некоторых двухосновных кислот:
| Кислота | 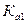 | 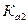 |
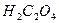 (щавелевая) (щавелевая) | 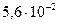 | 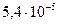 |
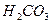 (угольная) (угольная) | 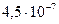 | 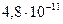 |
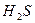 (сероводородная) (сероводородная) | 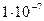 | 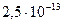 |
Формально суммарное уравнение диссоциации двухосновной слабой кислоты имеет вид:
Н2А ↔ 2Н+ + А2-
и ему соответствует общая (суммарная) константа кислотной диссоциации:
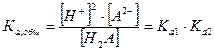
чье значение равно произведению ступенчатых констант диссоциации. Так как диссоциация многоосновной кислоты по первой ступени всегда протекает значительно сильнее, то и расчет рН в ее растворе проводится с использованием первой константы диссоциации и при условии, что 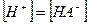 а
а 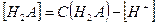 имеем
имеем
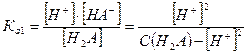
Тогда, если α < 0, то 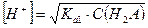 .
. 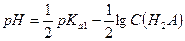 .
.
При α > 0,1 для определения 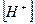 решают квадратное уравнение. Затем рассчитывают pH.
решают квадратное уравнение. Затем рассчитывают pH.
Равновесную концентрацию аниона [А2-] находят из второй константы диссоциации кислоты:
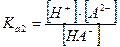
Так как 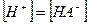 , то
, то 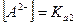 .
.
По первой ступени рассчитывается рН и в растворах других многоосновных кислот, например, трехосновных H3PO4, H3AsO4, H3SbO3 и т.д.
 2015-03-20
2015-03-20 2491
2491
