Таблица 4 – Диссоциация
| 1. Нормальные (средние) Fe2(SO4)3→2Fe3++3SO42- CuCl2 → Cu2+ + 2 Cl‾ | 2. Кислые NaHCO3 → Na+ + HCO3‾ сл. эл-т HCO3‾↔ H+ + CO32- | 3. Основные MgOHCl 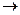 MgOH+ +Cl‾ MgOH+ ↔Mg2++OH‾ MgOH+ +Cl‾ MgOH+ ↔Mg2++OH‾ |
| 4. Двойные KAl(SO4)2→K++Al3++2SO42- | 5. Смешанные CaOCl2→Ca2++Cl‾+OCl‾ | 6. Комплексные K3[Fe(CN)6]→3K++[Fe(CN)6]3+ |
Выводы:
1. Соли – электролиты, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков.
2. Нормальные, двойные, смешанные и комплексные соли диссоциируют по типу сильного электролита (необратимо) только в одну ступень.
3. Кислые, основные соли диссоциируют ступенчато, но по первой ступени необратимо (по типу сильного электролита), а далее – обратимо, как слабые электролиты.
 2015-01-07
2015-01-07 3431
3431







