План.
1. Состав атома. Модель строения атома.
2. Состояние электронов в атоме.
3. Строение электронных оболочек атомов 1-4 периодов.
4. Зависимость свойств элементов от электронной конфигурации. Электроотрицательность. Металлические и неметаллические свойства.
5. Понятие о химической связи. Виды связи: ковалентная, ионная, металлическая. Полярность связи. Валентность. Структурные формулы.
6. Кристаллические решетки. Зависимость свойств веществ от типа кристаллической решетки.
7. Степень окисления. Окислительно-восстановительные процессы.
Атом – мельчайшая химически неделимая частица, но эта частица имеет сложное строение. В 1911 г. Резерфордом была предложена планетарная модель строения атома. Чуть позже – в 1913 г появилась теория теория Бора. Суть их теорий сформулировать так:
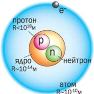 В центре атома находится положительное ядро, занимающее ничтожную часть пространства атома. Вокруг ядра двигаются электроны, они образуют т.н. электронную оболочку. Их общий заряд равен заряду ядра атома, но с противоположным знаком. Атом – электронейтральная частица.
В центре атома находится положительное ядро, занимающее ничтожную часть пространства атома. Вокруг ядра двигаются электроны, они образуют т.н. электронную оболочку. Их общий заряд равен заряду ядра атома, но с противоположным знаком. Атом – электронейтральная частица.
Ядро атома состоит из протонов и нейтронов, их иногда называют нуклонами. Разные Виды атомов с разным числом протонов и нейтронов называют нуклидами. В ядре сосредоточена почти вся масса атома. Масса протона 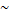 1 а.е.м., масса нейтрона
1 а.е.м., масса нейтрона 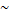 1 а.е.м., масса электрона = 1/1823 а.е.м., поэтому масса электронной оболочки ничтожно мала по сравнению с массой ядра. Число протонов в атоме называют протонным числом атома. Совокупность атомов с одинаковым числом протонов называют химическим элементом. Протонное число совпадает с порядковым номером элемента в ПС. Ядро заряжено положительно, а т.к. заряд протона = +1, нейтрона = 0, заряд ядра определяется числом протонов и равен тоже порядковому номеру элемента. Сумма протонов и нейтронов называется массовым числом элемента. Потому что именно сумма протонов и нейтронов определяет массу атома. Порядковый номер (протонное число) и массовое (нуклонное) число – важнейшие характеристики атома. Их указывают около знака химического элемента, например: 2311Na. Если у атомов одинаковое число протонов, но разное число нейтронов, такие атомы называют изотопами. Т.е. Na Например: 126С и 136С. Иногда с другой стороны от знака химического элемента записывают число нейтронов, т.е. для 126С - 126С6, а для 136С - 136С7. Различают стабильные и радиоактивные изотопы. Зная массовую долю всех изотопов химического элемента и их массовое число мы можем вычислить среднюю атомную массу элемента.
1 а.е.м., масса электрона = 1/1823 а.е.м., поэтому масса электронной оболочки ничтожно мала по сравнению с массой ядра. Число протонов в атоме называют протонным числом атома. Совокупность атомов с одинаковым числом протонов называют химическим элементом. Протонное число совпадает с порядковым номером элемента в ПС. Ядро заряжено положительно, а т.к. заряд протона = +1, нейтрона = 0, заряд ядра определяется числом протонов и равен тоже порядковому номеру элемента. Сумма протонов и нейтронов называется массовым числом элемента. Потому что именно сумма протонов и нейтронов определяет массу атома. Порядковый номер (протонное число) и массовое (нуклонное) число – важнейшие характеристики атома. Их указывают около знака химического элемента, например: 2311Na. Если у атомов одинаковое число протонов, но разное число нейтронов, такие атомы называют изотопами. Т.е. Na Например: 126С и 136С. Иногда с другой стороны от знака химического элемента записывают число нейтронов, т.е. для 126С - 126С6, а для 136С - 136С7. Различают стабильные и радиоактивные изотопы. Зная массовую долю всех изотопов химического элемента и их массовое число мы можем вычислить среднюю атомную массу элемента.
Т.к. заряд ядра равен заряду электронной оболочки, а у каждого электрона заряд (-1), то число протонов равно числу электронов. Эти электроны двигаются по определенным орбитам вокруг ядра.
Эта модель атома очень наглядна и полезна. Но сразу возник вопрос. Согласно электромагнитной теории, двигаясь по орбите с ускорением электрон должен непрерывно излучать энергию, а значит он будет двигаться по спирали и рано или поздно упадет на ядро. К этому времени была доказана дискретность электрической энергии. Поэтому Бор выдвинул гипотезу – двигаясь по орбите электрон не излучает энергии, это происходит только при переходе с одной орбитали на другую.
Современная ТСА возникла как результат переосмысления и дополнения теорий Резерфорда и Бора. Самым важным понятием стало понятие об электронном облаке, которое пришло на смену понятию об электроне как частице. Современная теория строения атома учитывает волновые свойства электрона.
У электрона двойственная природа. Как частица он имеет определенную массу и заряд, а как волна – способность огибать препятствие (дифракция). Для электрона нельзя одновременно точно измерить координаты и энергию. Он двигается с очень большой скоростью и характер движения у него – вероятностный. Т.е. он двигается не по определенной траектории, а хаотично, в пространстве около ядра, причем вероятность пребывания его в разных точках этого пространства неодинакова. Это пространство около ядра, где пребывание электрона наиболее вероятно называют электронным облаком или электронной орбиталью.
Орбитали имеют определенные размеры, форму и располагаются в пространстве определенным образом. Для характеристики этих свойств орбиталей используют квантовые числа. Их всего 4.
Главное квантовое число определяет размеры орбитали, а значит и степень удаленности от ядра. Именно от главного числа (размера орбитали) больше всего зависит энергия электрона. Орбитали приблизительно одного размера образуют электронный слой (электронный уровень). Число может иметь значения n = 1,2,3,4… и чем больше значение n, тем больше, обычно, энергия электрона. Часто строение атома изображают в виде схемы:
 т.е. для натрия (№11) +11)2)8)1
т.е. для натрия (№11) +11)2)8)1
Уровни делят на подуровни. Причем число возможных подуровней равно номеру данного уровня. Т.е. на 1 уровне 1 подуровень, на 2 – 2, на 3 -3 и т.д.
Подуровни образованы орбиталями, одинаковыми не только по размеру, но и по форме. Эту форму орбитали определяет второе (орбитальное) квантовое число. Подуровни принято обозначать буквами:
1 уровень – 1s
2 уровень – 2s, 2p
3 уровень – 3s,3p, 3d
4 уровень – 4s, 4p, 4d, 4f…
Третье квантовое число называют магнитным, оно определяет ориентацию орбитали в пространстве и их число на подуровне. Для s -подуровня число таких орбиталей на любом уровне равно 1. Для р-подуровня – 3. Для d -5. Для f – 7…


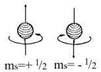 Четвертое орбитальное число характеризует собственное состояние электрона в атоме, которое, упрощенно, можно представить как момент собственного вращения электрона. Оно может иметь только два значения, т.е. (упрощенно) вращение либо в одну сторону, либо в другую. Эту характеристику электрона называют спином, а число – спиновым. Т.е. электроны, которые имеют три одинаковых квантовых числа должны иметь разное значение спина.
Четвертое орбитальное число характеризует собственное состояние электрона в атоме, которое, упрощенно, можно представить как момент собственного вращения электрона. Оно может иметь только два значения, т.е. (упрощенно) вращение либо в одну сторону, либо в другую. Эту характеристику электрона называют спином, а число – спиновым. Т.е. электроны, которые имеют три одинаковых квантовых числа должны иметь разное значение спина.
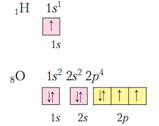 Итак, электроны размещаются на разных расстояниях от ядра, т.к. имеют разную энергию. Электронные слои образуются орбиталями, близкими по энергии. Их чаще называют электронными уровнями. Главное квантовое число (электронный уровень равен номеру периода, в котором находится элемент. Распределение электронов в атоме по уровням и подуровням называют электронной конфигурацией атома. Эта конфигурация записывается с помощью электронных формул. Для составления такой формулы следует знать некоторые правила.
Итак, электроны размещаются на разных расстояниях от ядра, т.к. имеют разную энергию. Электронные слои образуются орбиталями, близкими по энергии. Их чаще называют электронными уровнями. Главное квантовое число (электронный уровень равен номеру периода, в котором находится элемент. Распределение электронов в атоме по уровням и подуровням называют электронной конфигурацией атома. Эта конфигурация записывается с помощью электронных формул. Для составления такой формулы следует знать некоторые правила.
 1). Правило Клечковского или принцип минимума энергии, т.е. в стабильном (стационарном) состоянии электроны сначала заполняют орбитали с меньшим уровнем энергии. Энергия электрона зависит от суммы главного и от орбитального квантового числа, то по возрастанию энергии орбитали образуют ряд:
1). Правило Клечковского или принцип минимума энергии, т.е. в стабильном (стационарном) состоянии электроны сначала заполняют орбитали с меньшим уровнем энергии. Энергия электрона зависит от суммы главного и от орбитального квантового числа, то по возрастанию энергии орбитали образуют ряд:
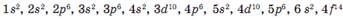
2). Принцип запрещения Паули, в атоме не может быть двух одинаковых электронов, т. е. с одинаковым набором 4-х квантовых чисел. Значит на одной орбитали может быть не более двух электронов, причем, с противоположными спинами.
Орбитали можно условно изображать клеточками – ячейками. И в одной клеточке мы рисуем или ↓↑, или только ↓, или только↑. Но ↑↑ - запрещено принципом Паули.
 3). Правило Хунда. На одном подуровне значение спинового числа электронов должно быть максимально, а это значит, что заполнение электронами подуровня сначала происходит по одному, а только потом – происходит спаривание.
3). Правило Хунда. На одном подуровне значение спинового числа электронов должно быть максимально, а это значит, что заполнение электронами подуровня сначала происходит по одному, а только потом – происходит спаривание.  - запрещено!
- запрещено!
 К середине 19 века было известно более 60 химических элементов, но были большие трудности с их классификацией. Много попыток в этом направлении было сделано, но разгадать тайну природы удалось только Д.И.Менделееву. Проанализировав все известные на тот момент данные об элементах, Менделеев сделал вывод, что «Все свойства химических элементов и их соединений находятся в периодической зависимости от их атомных масс». Графическим выражением ПЗ стала ПС. Он открыл эту закономерность, когда о сложном строении атома ученые не имели не малейшего представления. Только в 20-е годы 20 века стало ясно строение атома, и то что элементы размещены в таблице по увеличению заряда ядра элементов (протонного числа), и закономерности в изменении их свойств связаны с изменением электронной конфигурации
К середине 19 века было известно более 60 химических элементов, но были большие трудности с их классификацией. Много попыток в этом направлении было сделано, но разгадать тайну природы удалось только Д.И.Менделееву. Проанализировав все известные на тот момент данные об элементах, Менделеев сделал вывод, что «Все свойства химических элементов и их соединений находятся в периодической зависимости от их атомных масс». Графическим выражением ПЗ стала ПС. Он открыл эту закономерность, когда о сложном строении атома ученые не имели не малейшего представления. Только в 20-е годы 20 века стало ясно строение атома, и то что элементы размещены в таблице по увеличению заряда ядра элементов (протонного числа), и закономерности в изменении их свойств связаны с изменением электронной конфигурации  атомов.
атомов.
В образовании химических связей обычно принимают участие электроны внешнего электронного слоя. Их принято называть валентными. У элементов побочных подгрупп в образовании связей могут участвовать и d-электроны. Число электронов на внешнем слое для элементов главных подгрупп (s и p элементы) равно номеру группы и совпадает с максимальной валентностью и максимальной степенью окисления элемента.
Наиболее выгодной энергетически является электронная конфигурация заполненного электронного слоя - s2p6 (для 1 слоя просто s2). (Выгодными энергетически являются также заполненные подуровни и наполовину заполненные подуровни). Поэтому все элементы стремятся завершить свой электронный слой, чтобы иметь такую конфигурацию. Для этого элементы либо отдают валентные электроны, либо присоединяют их, забирая у других атомов.
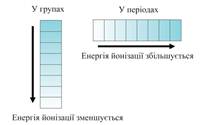
 Количество энергии, необходимой для отрыва от атома одного электрона называется энергией ионизации. Чем меньше энергия ионизации, тем больше металлических свойств проявляет элемент. Наименьшей энергией ионизации обладают Если элемент завершает свой уровень только отдавая электроны, он относится к металлам. Но когда электронный слой s-элементы. Это типичные металлы. У d-элементов идет заполнение предпоследнего слоя, а на внешнем остаются тоже 2 электрона. Значит это тоже металлы, но уже не типичные, а «переходные». С увеличением радиуса атомов электрон слабее связан с ядром, поэтому в подгруппе металлические свойства усиливаются сверху вниз. Но у р-элементов возможно завершение внешнего слоя за счет притяжения к себе чужих электронов. Это свойство элементов называют электроотрицательностью (ЭО).
Количество энергии, необходимой для отрыва от атома одного электрона называется энергией ионизации. Чем меньше энергия ионизации, тем больше металлических свойств проявляет элемент. Наименьшей энергией ионизации обладают Если элемент завершает свой уровень только отдавая электроны, он относится к металлам. Но когда электронный слой s-элементы. Это типичные металлы. У d-элементов идет заполнение предпоследнего слоя, а на внешнем остаются тоже 2 электрона. Значит это тоже металлы, но уже не типичные, а «переходные». С увеличением радиуса атомов электрон слабее связан с ядром, поэтому в подгруппе металлические свойства усиливаются сверху вниз. Но у р-элементов возможно завершение внешнего слоя за счет притяжения к себе чужих электронов. Это свойство элементов называют электроотрицательностью (ЭО).
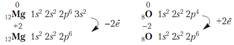
Элементы с высокой ЭО относятся к неметаллам.
В периодах ЭО увеличивается с увеличением номера, в подгруппах – уменьшается. Поллингу удалось измерить эту ЭО и он расположил элементы в ряд:

Зная положение элемента в ПС мы может характеризовать его электронное строение и свойства.
Характеристика элемента по ПС (план)
1) положение в ПС (порядковый номер, период, группа, подгруппа, атомная масса)
2) состав атома (число протонов, нейтронов, электронов)
3) распределение электронов по уровням, подуровням, орбиталям (схема строения, электронная формула, квантовые ячейки).
4)характеристика электронного строения и свойств элемента и его соединений (число электронных слоев, завершен ли внешний электронный слой, сколько на нем электронов, какова ЭО элемента, характерные степени окисления; число неспаренных электронов, свободных орбиталей, возможная валентность элемента, характеристика соединений элемента-оксида и гидроксида, ЛВС);
Вывод: металлические или неметаллические свойства элемента, и сравнение свойств элемента с соседями по периоду и подгруппе.
 Только инертные газы в стандартных условиях находятся в одноатомном состоянии. Все остальные, стремясь завершить свой внешний электронный слой, образуют химические связи. Это стремление иметь 8 электронов на внешнем слое называют правилом октета. Обычно, перед тем как вступить в химическую реакцию атом должен получить дополнительную энергию и перейти в возбужденное состояние.
Только инертные газы в стандартных условиях находятся в одноатомном состоянии. Все остальные, стремясь завершить свой внешний электронный слой, образуют химические связи. Это стремление иметь 8 электронов на внешнем слое называют правилом октета. Обычно, перед тем как вступить в химическую реакцию атом должен получить дополнительную энергию и перейти в возбужденное состояние.
 Химическая связь имеет электронную природу, т.е. образуется за счет взаимодействия между ядрами и электронами атомов. Существует несколько видов химической связи.
Химическая связь имеет электронную природу, т.е. образуется за счет взаимодействия между ядрами и электронами атомов. Существует несколько видов химической связи.
Ковалентная связь образуется за счет общих электронных пар. Она характерна для неметаллов, т.е. элементов с высокой ЭО.

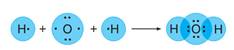 Различают ковалентную полярную связь и ковалентную неполярную связь (КП и КНП). Если атомы, образующие связь одинаковы, то электронная пара в равной степени принадлежит обоим атомам, и связь называют КНП. Если атомы разные, то электронная пара смещена к более ЭО атому, появляются на атомах частичные заряды, «полюса», связь КП.
Различают ковалентную полярную связь и ковалентную неполярную связь (КП и КНП). Если атомы, образующие связь одинаковы, то электронная пара в равной степени принадлежит обоим атомам, и связь называют КНП. Если атомы разные, то электронная пара смещена к более ЭО атому, появляются на атомах частичные заряды, «полюса», связь КП.
Если элементы очень сильно отличаются по ЭО, т.е. принадлежат один к металлам, другой к неметаллам, то электроны полностью переходят к более ЭО атому, образуются реальные заряды на атомах. Атомы превращаются в ионы. Связь между ионами называют ионной.
Простые вещества – металлы образуют особый вид химической связи, которую называют металлической. Она осуществляется валентными электронами, которые находятся в общем владении всех атомов металла (электронный газ).
 Множество атомов соединяясь между собой образуют вещества. В твердом состоянии вещества могут иметь упорядоченную (кристаллическую) и неупорядоченную (аморфную) структуру. Модель кристаллического состояния вещества называют кристаллической решеткой. В зависимости от вида частиц, которые образуют кристаллическую решетку и типа химической связи в ней принято различать молекулярную, ионную, атомную и металлическую кристаллическую решетку. Чем прочнее связь между частицами, тем выше температура плавления вещества, больше твердость. Чем полярнее связи, тем больше вероятность растворения вещества в воде.
Множество атомов соединяясь между собой образуют вещества. В твердом состоянии вещества могут иметь упорядоченную (кристаллическую) и неупорядоченную (аморфную) структуру. Модель кристаллического состояния вещества называют кристаллической решеткой. В зависимости от вида частиц, которые образуют кристаллическую решетку и типа химической связи в ней принято различать молекулярную, ионную, атомную и металлическую кристаллическую решетку. Чем прочнее связь между частицами, тем выше температура плавления вещества, больше твердость. Чем полярнее связи, тем больше вероятность растворения вещества в воде.
Важной характеристикой элемента является его степень окисления. Степень окисления - это условный заряд, который мог бы появиться на атоме, если бы все электроны образующие его химические связи сместились к более электроотрицательному атому.
 2015-01-07
2015-01-07 3528
3528